ARTÍCULO ORIGINAL
Combinación de formas de aplicación de quitosano en el desarrollo de soya biofertilizada
Combination of application forms of chitosan in the development of biofertilized soybean
Dra.C. Daimy Costales-Menéndez, Dr.C. Alejandro B. Falcón-Rodríguez
Instituto Nacional de Ciencias Agrícolas (INCA), carretera San José-Tapaste, km 3½, Gaveta Postal 1, San José de las Lajas, Mayabeque, Cuba. CP 32700
RESUMEN
En este trabajo se evaluó la aplicación combinada de adición a semillas y aspersión foliar de un polímero de quitosano en el desarrollo de plantas de soya (Glycine max (L.) Merril), cultivar IS-27, inoculadas con el biofertilizante Azofert-S ® . Se determinaron variables de nodulación y de crecimiento en las fases R2 y R5, así como los componentes del rendimiento en la cosecha (R8). El experimento se realizó en época de invierno, en un área experimental del Instituto Nacional de Ciencias Agrícolas, mediante un diseño de Bloques al Azar en campo. Previo a la siembra, las semillas fueron tratadas con una mezcla de Azofert-S ® y quitosano (0,01, 0,1 y 1 g L-1). Estas concentraciones, se aplicaron por aspersión foliar en las fases V2 y R2 del cultivo. La combinación de ambas formas de aplicación de quitosano benefició la nodulación y el crecimiento del cultivar en la fase R2, específicamente, el número y la masa nodular seca, el número de flores, la longitud del tallo, la masa seca aérea, el área foliar y la concentración de nitrógeno en nódulos y semillas, al aplicar 1 g L-1. En la fase R5 de desarrollo de IS-27, solo se benefició la longitud del tallo, mientras que en la cosecha fue el número de vainas con la aplicación de quitosano a 0,01 g L-1. El resto de los componentes del rendimiento no fueron estimulados con la combinación de las formas de aplicación de quitosano, Es posible, que las formas de aplicación por separado del quitosano, mejoren la productividad de la soya, por lo que debe demostrarse en estudios posteriores.
Palabras clave: bioestimulante, Glycine max, inoculación, polímero.
ABSTRACT
In this work the combined application of seed addition and foliar spraying of a chitosan polymer in the development of soybean plants (Glycine max (L.) Merril), cultivar IS-27, inoculated with the biofertilizer Azofert-S ® was evaluated. Nodulation and growth variables were determined in phases R2 and R5, as well as the components of crop yield (R8). The experiment was carried out in the winter season, in an experimental area of the National Institute of Agricultural Sciences, using a random blocks design in the field. Prior to sowing, the seeds were treated with a mixture of Azofert-S ® and chitosan (0,01, 0,1 and 1 g L-1). These concentrations were applied by foliar spray in phases V2 and R2 of the crop. Combination of both forms of application of chitosan benefited the nodulation and growth of the cultivar in R2 phase, specifically, the number and dry nodular mass, number of flowers, length of the stem, aerial dry mass, foliar area and the concentration of nitrogen in nodules and seeds, when applying 1 g L-1. In the R5 phase of development of IS-27, only the length of the stem was benefited, while in the harvest it was the number of pods with the application of chitosan at 0,01 g L-1. The rest of the components of the yield were not stimulated with the combination of the forms of chitosan application. It is possible that the separate application of both chitosan application forms, improve the productivity of the soybean, so it must be demonstrated in later studies.
Key words: biostimulants, Glycine max, inoculation, polymer.
INTRODUCCIÓN
Glycine max (L.), Merrill, constituye uno de los cultivos más ricos en proteína y aceite, por lo que es la oleaginosa más llamativa y con mayores perspectivas en la elaboración de diversidad de alimentos para consumo humano y animal (1). Es un cultivo con alta demanda de nitrógeno (N), siendo el nutriente más crítico para su desarrollo (2). Los requerimientos de este nutriente pueden ser cubiertos a partir del aporte de N del suelo por la mineralización de N orgánico y por medio de la fijación biológica del dinitrógeno atmosférico (FBN). Este último, representa el proceso de mayor impacto en la producción mundial, ya que las leguminosas pueden ser cultivadas sin fertilización nitrogenada, si son inoculadas adecuadamente con bacterias rizobeaceas (3).
La soya se asocia simbióticamente con bacterias del género Bradyrhizobium y forman nódulos capaces de fijar nitrógeno con eficiencia, por lo que se desarrollan y se comercializan biofertilizantes con cepas seleccionadas de rizobios (4–6). Los biofertilizantes constituyen una excelente alternativa como bioestimuladores del crecimiento, proveen una mayor eficiencia en la fijación y utilización del nitrógeno, además de garantizar un aumento en los rendimientos de los cultivos y una reducción en los costos, comparado con los fertilizantes nitrogenados (3,7).
Por otra parte, los bioestimulantes elaborados a base de polímeros de quitosano se aplican de diversas formas en diferentes cultivos de interés económico y actúan como reguladores del crecimiento y la fisiología de la planta, además de activar respuestas defensivas y de protección contra diversos patógenos (8,9).
Aunque existen resultados de la acción bioestimulante del quitosano en experimentos in vitro y ex vitro de soya, con diferentes concentraciones y formas de aplicación (10,11), no se conoce si la combinación de aplicación a las semillas con la aspersión foliar beneficia el desarrollo del cultivo en condiciones de campo. Por tanto, el objetivo del trabajo fue evaluar la combinación de las formas de aplicación de quitosano antes mencionadas, en la nodulación, el crecimiento y los rendimientos de soya (cultivar IS-27) biofertilizada con el inoculante Azofert-S ® .
MATERIALES Y METODOS
La investigación se desarrolló en un área experimental del Instituto Nacional de Ciencias Agrícolas (INCA), ubicado en San José de las Lajas, provincia Mayabeque. Las coordenadas de dicha área son Latitud Norte (N: 353,05), Latitud Este: 382, 875) y una altitud de 138 msnm. El área experimental fue dividida mediante un diseño de Bloques al Azar, donde se utilizaron cuatro bloques de cinco surcos (5 m2) y cuatro repeticiones por tratamiento. Se empleó la tecnología de siembra directa a las distancias de 0,75 m entre surcos y 0,05 m entre plantas, con una dosis de 50 kg ha-1 de semillas, para asegurar al menos 35 plantas por metro cuadrado. El suelo que predomina en dicha área es Ferralítico Rojo Lixiviado típico, eútrico (12) y su caracterización se realizó, a partir de la toma de muestras entre 0 y 10 cm de profundidad, que se describieron morfológicamente. Las características químicas se determinaron por métodos analíticos (13) y contiene 3,7 % de materia orgánica (M.O), 16,3 Cmol kg-1 de calcio (Ca), 2,1 Cmol kg-1 de magnesio (Mg), 24,9 ppm de fósforo (P) y pH= 7. Estos valores de los elementos nutricionales evaluados en el suelo resultan adecuados para el cultivo de la soya, ya que este se caracteriza por una fertilidad media, con un porcentaje relativamente alto de materia orgánica, pH neutro y los contenidos de P, Ca y Mg son adecuados.
Características climatológicas
El experimento se realizó en época de invierno (enero-abril de 2015) y las variables climáticas que se registraron mensualmente, por la Estación Meteorológica de Tapaste (No. 78374, ubicada en el km 31/2 carretera a Tapaste, Mayabeque), fueron: temperaturas diurnas/nocturnas (28,05/16,73 oC), humedad relativa diurnas/nocturnas (87,87/49,14 %) y las precipitaciones acumuladas de 3,91 mm durante este período.
Efecto del quitosano adicionado a las semillas y por aspersión foliar en la nodulación y el crecimiento de soya en dos fasesde desarrollo (R2 y R5)
Las características físico-químicas principales del polímero de quitosano (Q) son su masa molar (124 kDa) y su grado de acetilación (13,7 %), que fueron determinadas por viscosimetría y lectura en el infrarrojo, respectivamente. A partir de una solución madre de 10 g L-1 del polímero se tomaron alícuotas correspondientes a las concentraciones 0,01; 0,1 y 1 g L-1 tanto para su aplicación a semillas, como por aspersión foliar.
Para la aplicación a la semilla, previo a la siembra, se elaboró una mezcla de las distintas concentraciones de quitosano e inóculo del biopreparado Azofert-S ® (No. RCF 005/13, L1, tomo 1, folio 033, 2013) a base de la cepa ICA 8001 de B. elkanii para el cultivo de soya (14). La viabilidad del inoculante fue de 8 x 109 UFC mL-1 y la mezcla aplicada a las semillas se correspondió con la dosis por hectárea. Se empleó como tratamiento control, semillas de soya (IS-27) inoculadas con Azofert-S ® sin adición de Q. Posteriormente, se realizaron aspersiones foliares al cultivo en la fase de crecimiento (V2) y de floración (R2), en horas tempranas de la mañana con una mochila de 16 L de capacidad. El riego se realizó de forma periódica y las atenciones culturales se realizaron de forma manual en el cultivo.
Los tratamientos que se utilizaron fueron los siguientes:
Q - 0 g L-1 (semillas inoculadas con Azofert-S ® (SI) sin tratar con quitosano)
Q - 0,01 g L-1 (SI + aspersión foliar V2 y R2)
Q - 0,1 g L-1 (SI + aspersión foliar V2 y R2)
Q - 1 g L-1 (SI + aspersión foliar V2 y R2)
Se seleccionaron 10 plantas por bloque (40 plantas por tratamiento) para las evaluaciones morfoagronómicas relacionadas con la nodulación y el crecimiento a plantas de soya en las fases R2 y R5 (plantas con vainas y semillas en desarrollo); mientras que se cosecharon 20 plantas por bloque, para un total de 80 plantas por tratamiento, para determinar el rendimiento agrícola y sus componentes evaluados en el momento de la cosecha (R8).
Las evaluaciones de nodulación fueron: número, masa seca (g) y porcentaje de efectividad (%) de los nódulos por planta. Este último fue expresado por el método visual de la eficiencia de los nódulos luego de un corte transversal de los mismos. También, se determinó la concentración de macronutrientes (%) en nódulos totales formados, en el tercer par de hojas trifoliadas y en semillas para cada tratamiento. El nitrógeno (N) fue determinado por el Método de Nessler, el fósforo (P) por el Método de Oniani, mediante cationes intercambiables por extracción con NH4Ac 1mol L-1 a pH= 7 y el potasio (K) por fotometría de llamas. Todas estas técnicas aparecen descritas en el Manual de Técnicas de Laboratorio publicado por Paneque et al. (13).
La variables morfoagronómicas relacionadas con el crecimiento que se evaluaron fueron el número de hojas, ramas, flores y vainas por planta, además del largo del tallo (g), la masa seca de la parte aérea, el contenido relativo de clorofilas totales (unidades SPAD) al tercer par de hojas trifoliadas (de arriba hacia abajo) con un medidor portátil Minolta SPAD* 502 plus y el área foliar (cm2) con el medidor portátil AM 300, UK, a cada planta.
Las medidas de color, como coordenadas CIELab (L*a*b*) y Delta-E* (ΔE*), se realizaron apoyando el visor del colorímetro (Minolta Chroma CR-400, Japón) en el tercer par de hojas trifoliadas, con color uniforme y fuera de la nervadura central. Las diferencias de color que se perciben como iguales del espacio de color tridimensional, tienen distancias iguales entre ellas. Esta diferencia se expresa mediante el valor ΔE*, que es la distancia entre los dos puntos dentro del espacio de color y necesita para ello los valores L*a*b*, para medir los cambios de matiz y densidad.La luminosidad, L*, corresponde al color blanco cuando su valor es 100 y al negro cuando es 0. La cromaticidad (tono y croma) se indica por a* y b* conjuntamente, a* representa el eje que va desde colores verdes (-a*) hasta colores rojos (+a*) y b* representa el eje que evoluciona desde el azul (-b*) hasta el amarillo (+b*).
Los componentes del rendimiento de soya evaluados fueron: el número de vainas totales; el número de granos por vaina y por planta; el porcentaje de vainas vanas (%); el peso de 100 semillas (g) y el rendimiento agrícola (t ha-1), a partir de granos secos hasta 14 % de humedad.
Diseño experimental y análisis estadísticode los datos
El experimento se repitió dos veces entre septiembre de 2014 y abril de 2015, con similar comportamiento de los resultados. Se presentan los resultados correspondientes al período de enero a abril de 2015. Los datos obtenidos se sometieron después de la verificación de las premisas del ANOVA, a un análisis de varianza de ANOVA Simple. Las medias resultantes se compararon con la Prueba de Duncan para p≤ 0,05, mediante el paquete estadístico Statgraphics Plus, versión 5. Los gráficos se realizaron en SigmaPlot.
RESULTADOS
Efecto del quitosano adicionado a las semillas y por aspersión foliar en la nodulación y el crecimiento de soya en dos fases de desarrollo (R2 y R5)
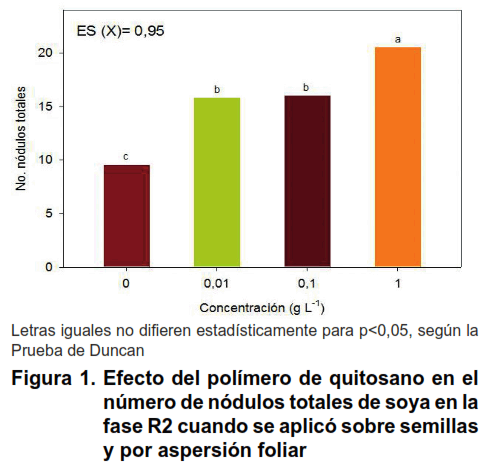
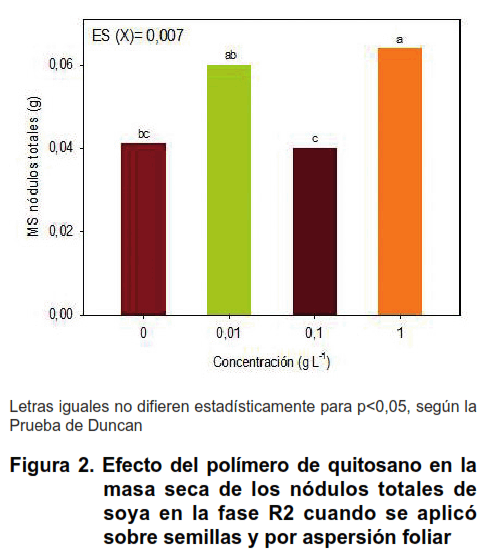
La mezcla del polímero de quitosano e inoculante Azofert-S ® que se aplicó sobre semillas previo a la siembra, favoreció el proceso de nodulación de la variedad IS-27, específicamente, el número, la masa seca y la efectividad de los nódulos totales, en la fase R2 de soya (Figuras 1 y 2).
El número de nódulos totales fue estimulado con las distintas concentraciones de quitosano, con valores superiores y diferentes del control inoculado con Azofert-S ® pero no tratado con el bioproducto. Todos los nódulos fueron 100 % efectivos.
La concentración de quitosano que más se destacó fue 1 g L-1 respecto a las concentraciones 0,01 y 0,1 g L-1, tanto en el número como en la masa seca de los nódulos totales formados en las raíces de soya (Figuras 1 y 2).
Ambas formas combinadas de aplicación del quitosano (sobre semillas más aspersión foliar) afectaron positivamente el proceso de crecimiento de la soya en R2 (Figuras 3, 4 y 5).
En el número de hojas trifoliadas, las concentraciones 0,1 y 1 g L-1 incidieron negativamente en esta variable respecto al control no tratado con quitosano, mientras que la concentración menor no se diferenció de este (Figura 3).
Sin embargo, el número de flores, la longitud del tallo y el área foliar de las plantas fueron estimulados con la concentración de 1 g L-1 de quitosano (Figuras 3 y 4). En esta última variable se obtuvo incrementos con quitosano de 62,85 %, respecto al control no tratado (Figura 5).
En la Tabla I, aparece la concentración de macronutrientes (N, P y K) determinada en nódulos totales y terceras hojas trifoliadas en la fase R2, así como en semillas (fase R8) de soya.
La concentración de nitrógeno en los nódulos y hojas de soya fue elevada en todos los tratamientos, lo que pudo deberse a una mayor fijación del N2 atmosférico por B. elkanii,contrariamente a lo que se acumuló en semillas (Tabla I). Todas las concentraciones del polímero se diferenciaron del control inoculado, siendo la mayor (1 g L-1), la que causó el mayor porcentaje de N en los nódulos, seguido de 0,1 g L-1.
El porcentaje de nitrógeno se redujo con el aumento de la concentración de quitosano en hojas de soya, a diferencia de 1 g L-1 del polímero, que favoreció la concentración de este elemento en semillas (Tabla I).
Sin embargo, los contenidos de P y K manifestaron diferencias significativas entre los tratamientos en dependencia del órgano de la planta evaluado. Tanto en hojas como en semillas, se destacó la concentración de 1 g L-1 de quitosano en acumular mayores porcentajes de K y P, respectivamente (Tabla I).
El quitosano fue evaluado en las fases R2 y R5 con ambas formas de aplicación y no hubo efecto alguno del mismo en las variables de desarrollo: número de ramas, flores y vainas, el contenido de clorofilas totales y la masa seca aérea, por no haber diferencias entre los tratamientos (Tabla II).
A pesar de encontrarse diferencias significativas en el número de trifoliolos, ninguna de las concentraciones del polímero se diferenció del control inoculado, mientras que la longitud del tallo fue estimulada con la concentración de 1 g L-1 de quitosano, por encima del resto de los tratamientos (Tabla II).
Según el Diagrama de cromaticidad CIEL*a*b*, se observaron diferencias significativas en las coordenadas de color en hojas de soya, excepto en Delta-E* de la fase R2 (Tabla III). Las cultivadas en R2 manifestaron mayor tonalidad verde en sus hojas trifoliadas que en R5, por causa de la luminosidad (L*) como resultante de las variables a* y b*. Además, los cambios de matiz y densidad de color ΔE* fueron mayores en R5, y se acentuaron en las plantas que se les aplicó el polímero.
En R2, los valores de color a* fueron negativos (-12,30 a -12,58) mientras que los valores de b* fueron positivos (19,46 a 21,92). Se obtuvo el valor menor de a* con la dosis de 100 mg L-1 del polímero respecto al control, de color verde, sin diferencias de la concentración de 1000 mg L-1. En la variable b*, la tonalidad verde es más acentuada con el tratamiento control sin diferencias con la concentración de 10 mg L-1 de quitosano. El valor de L* fue mayor en las plantas controles sin diferencias con la concentración de 1000 mg L-1 de quitosano. En R5, los valores de color a* fueron negativos (-9,10 a -9,81) y los tratamientos no mostraron diferencias significativas. En la variable b*, los valores fueron positivos (11,97 a 14,55) y mostraron un color verde claro, donde se destacó la concentración de 100 mg L-1 sin diferencias con el control. Por tanto, la luminosidad fue superior en las plantas controles respecto a las tratadas con quitosano. Las plantas tratadas con quitosana, tuvieron mayores valores Delta-E*, con diferencias significativas de las plantas controles.
Las variables de rendimiento fueron evaluadas en el momento de la cosecha cuando el cultivo se encontraba en la fase R8 (Tabla IV).
El quitosano influyó positivamente en el número de vainas con la concentración menor (0,01 g L-1), que también arrojó el mayor número de vainas vanas (20 %), en contraste con la concentración intermedia (0,1 g L-1) que obtuvo aproximadamente 14 %. El resto de las concentraciones del polímero no difirieron del control inoculado (Tabla IV).
El peso de 100 granos fue mayor con el control inoculado sin diferencias con la concentración de 0,01 g L-1, con valores superiores a las concentraciones mayores de quitosano probadas. En el resto de los componentes del rendimiento (número de granos por vaina, número de granos por planta y rendimiento agrícola) no se apreciaron diferencias significativas entre los tratamientos (Tabla IV).
DISCUSIÓN
En este trabajo, la combinación de dos formas de aplicación de quitosano en plantas de soya biofertilizadas con Azofert-S ® ejerció un efecto positivo en los procesos de nodulación y de crecimiento del cultivar IS-27.
La concentración mayor (1 g L-1) de quitosano, estimuló tanto las variables de nodulación como las de crecimiento (número de flores, longitud del tallo, masa seca aérea, área foliar, concentración de nitrógeno en nódulos y semillas maduras, además de color (Delta-E*) en hojas de soya, en la fase R2 (Figuras 1, 2, 3, 4, 5 y Tablas I y III).
Sin embargo, la segunda aplicación de quitosano no modificó dichas variables respecto a las plantas inoculadas y no tratadas con quitosano en la fase R5, excepto la longitud del tallo, el número de hojas (Tabla II) y el rendimiento con sus componentes (Tabla IV).
La combinación de las formas de aplicación de quitosano redujo la concentración de nitrógeno en hojas trifoliadas de soya (Tabla I), a pesar, de obtenerse mayor masa seca aérea y área foliar con la concentración de 1 g L-1 (Figuras 4 y 5). Sin embargo, la concentración de nitrógeno en los nódulos y semillas de soya fue elevada en todos los tratamientos con quitosano, lo que demuestra el beneficio del polímero al proceso de fijación del N2 atmosférico por B. elkanii y quizás también por la absorción de nutrientes desde el suelo. Todas las concentraciones de quitosano se diferenciaron del control inoculado, siendo la concentración mayor (1 g L-1) la que acumuló mayor porcentaje de N en los órganos antes mencionados (31 % de incremento en los nódulos respecto al tratamiento control), seguido de 0,1 g L-1 (Tabla I). Sin embargo, otras formas de aplicación conjunta de quitosano y rizobios aumentaron este indicador en plantas de caupí (Vigna unguiculata) y maíz (Zea mays) con aumentos de hasta un 40 % del contenido de nitrógeno (15,16).
El inicio del cambio de color, es un indicador confiable de importantes transiciones de desarrollo en diferentes órganos de la planta, por la acumulación de pigmentos (clorofilas, antocianinas, entre otros). De hecho, se identifican cambios fisiológicos asociados a cambios en las relaciones fuente-sumidero y se relacionan al déficit de nitrógeno e hídrico en los cultivos (17–19).
En leguminosas, se identifican aquellas características morfológicas que marcan la transición entre las fases reproductivas, desde la aparición del primer botón floral hasta la madurez de cosecha (17).
En este trabajo, los mayores valores de Delta-E* fueron en la fase R5, con los tratamientos de quitosano, respecto al control. Por consiguiente, esto se pudiera relacionar con un adelanto de la fase de desarrollo del cultivo, aunque todos los tratamientos se encuentren en la misma zona cromática de color.
Son diversos los estudios que corroboran el papel del quitosano, mediante diferentes formas de aplicación en la germinación, el crecimiento, la fisiología y los rendimientos de diferentes cultivos (11,20–24).
La forma de aplicación y la concentración de quitosano, entre otros factores, son de gran relevancia en la estimulación de estos procesos (11,23,24). En IS-27, el Grupo de Productos Bioactivos del INCA, obtuvo incrementos de las mismas variables de crecimiento evaluadas en este trabajo, así como también, el aumento del porcentaje de nitrógeno y proteínas en hojas y la masa seca de los nódulos cuando solo se aplicó a semillas el polímero a concentraciones de 0,1 y 0,5 g L-1, conjuntamente con el inóculo de B. elkanii (11). Otros autores, estimularon el crecimiento y protegieron al cultivo de enfermedades con la misma forma de aplicación, pero con concentraciones mayores (5 a 10 g L-1) a las probadas en este trabajo (25,26). Todo lo anterior demuestra la eficacia de la aplicación de quitosano a las semillas, con un rango amplio de concentraciones, en el desarrollo de soya.
Respecto a la forma de aplicación por aspersión foliar, hay un número importante de resultados informados en varios procesos y especies de plantas (27–30). Por ejemplo, la aplicación de oligómeros de quitina y quitosano a 1 g L-1 causó variaciones en la fotosíntesis, la conductancia estomática, la transpiración y concentración de dióxido de carbono (CO2) intercelular en soya (27). Previamente, en laboratorio se obtuvo mejoras en la nodulación, el crecimiento y la formación de vainas con la aspersión foliar de quitosanos en diferentes condiciones del cultivar IS-27 (10,11).
La concentración mayor de quitosano, a pesar de estimular algunas variables durante las fases del crecimiento de soya, no estimuló de la misma forma el rendimiento y sus componentes. El número de vainas por planta solo se elevó con la concentración de 0,01 mg L-1, ya que las restantes concentraciones incidieron negativamente en el peso de los 100 granos y el rendimiento total respecto al control (Tabla IV). Por lo anterior y los resultados de este trabajo, sugieren que es posible lograr un mayor efecto beneficioso en el desarrollo del cultivar, si se aplican las formas de aplicación por separado del quitosano.
El rendimiento agrícola de IS-27 fue bajo con todos los tratamientos (Tabla IV), ya que el rendimiento esperado con este cultivar es de 3 t ha-1 con bajos insumos (31). Este comportamiento puede deberse a la época de invierno, que causa reducciones en la acumulación de masa seca aérea y en la translocación de asimilados del follaje al grano.
Se conoce que este cultivar tiene mayor productividad en primavera porque requiere de radiación solar alargada e intensa, además de numerosas precipitaciones, por lo que resulta de suma importancia la relación entre genotipo-ambiente (factores climatológicos). En este sentido, se demostró que algunas condiciones edafoclimáticas, fundamentalmente la fecha de siembra, influyen en la obtención del rendimiento de cultivares de soya en una misma localidad (32,33).
Sería de gran interés evaluar el efecto del quitosano, en la interacción simbiótica y en el desarrollo del cultivar inoculado con Azofert-S ® , en época de primavera.
CONCLUSIONES
La aplicación combinada de quitosano a las semillas y por aspersión foliar de soya biofertilizada, mejoró el desarrollo de las plantas, en dependencia de su concentración y de la fase fisiológica del cultivar IS-27.
La concentración de 1 g L-1 de quitosano en la fase V2, favoreció la nodulación además de la concentración de 0,1 g L-1 en la fase R2, que estimularon el crecimiento del cultivo, específicamente, la longitud del tallo, la masa seca de la parte aérea, el área foliar con incrementos de 62,85 % y la concentración de nitrógeno en nódulos y semillas.
En la fase R5, no hubo un efecto beneficioso del quitosano en el rendimiento de IS-27, cultivado en época de invierno.
Se deben realizar más experimentos para llegar a una conclusión válida con respecto a la aplicación combinada de quitosano, para mejorar la productividad de soya inoculada con Azofert ® .
BIBLIOGRAFÍA
1. Ainsworth E A, Yendrek CR, Skoneczka J A, Long S P. Accelerating yield potential in soybean: potential targets for biotechnological improvement: Targets to improve soybean yields. Plant, Cell & Environment. 2012;35(1):38–52. doi:10.1111/j.1365-3040.2011.02378.x
2. Xu G, Fan X, Miller A J. Plant Nitrogen Assimilation and Use Efficiency. Annual Review of Plant Biology. 2012;63(1):153–82. doi:10.1146/annurev-arplant-042811-105532
3. Callaghan M. Microbial inoculation of seed for improved crop performance: issues and opportunities. Applied Microbiology and Biotechnology. 2016;100(13):5729–46. doi:10.1007/s00253-016-7590-9
4. Nápoles MC, Gómez G, Costales D. Signals in Soybean´s Inoculants. In: Soybean - Biochemistry, Chemistry and Physiology [Internet]. INTECH Open Access Publisher; 2011. Available from: http://www.intechopen.com/articles/show/title/signals-in-soybean-s-inoculants
5. De Souza R, Ambrosini A, Passaglia L MP. Plant growth-promoting bacteria as inoculants in agricultural soils. Genetics and molecular biology. 2015;38(4):401–19. doi:10.1590/S1415-475738420150053
6. Ulzen J, Abaidoo RC, Mensah N E, Masso C, AbdelGadir AH. Bradyrhizobium inoculants enhance grain yields of soybean and cowpea in Northern Ghana. Frontiers in plant science. 2016;7:1770. doi:10.3389/fpls.2016.01770
7. De Bashan L E, Antoun H, Bashan Y. Involvement of Indole-3-Acetic Acid Produced by the Growth-Promoting Bacterium Azospirillum Spp. in Promoting Growth of Chlorella Vulgaris. Journal of Phycology. 2008;44(4):938–47.
8. Falcón AB, Costales D, González P D, Nápoles MC. Nuevos productos naturales para la agricultura: las oligosacarinas. Cultivos Tropicales. 2015;36(1):111–29.
9. Pichyangkura R, Chadchawan S. Biostimulant activity of chitosan in horticulture. Scientia Horticulturae. 2015;196(30):49–65. doi:10.1016/j.scienta.2015.09.031
10. Costales D, Falcón A B, Nápoles M C, De Winter J, Gerbaux P, Onderwater RCA, et al. Effect of chitosaccharides in nodulation and growth in vitro of inoculated soybean. American Journal of Plant Sciences. 2016;7(09):1380–91. doi:10.4236/ajps.2016.79131
11. Costales D, Nápoles MC, Falcón R A B, González Anta GFA, Rossi A. Influencia de quitosanas en la nodulación y el crecimiento vegetativo de soya (Glycine max L. Merrill). Cultivos Tropicales. 2017;38(1):138–46.
12. Hernández A, Morales M, Borges Y, Vargas D, Cabrera JA, Ascanio MO, et al. Degradación de las propiedades de los suelos Ferralíticos Rojos lixiviados de la “Llanura Roja de La Habana”, por el cultivo continuado. Algunos resultados sobre su mejoramiento. La Habana, Cuba: Ediciones INCA; 2014.
13. Paneque PVM, Calaña NJM, Calderón VM, Borges BY, Hernández GTC, Caruncho CM. Manual de técnicas analíticas para análisis de suelo, foliar, abonos orgánicos y fertilizantes químicos [Internet]. 1ra ed. La Habana, Cuba: Ediciones INCA; 2010. 157 p. Available from: http://mst.ama.cu/578/
14. Nápoles MC. Medio de cultivo para Bradyrhizobium japonicum. Biopreparado resultante. OCPI; 22 797.
15. Berger LR, Stamford NP, Santos CERS, Freitas ADS, Franco LO, Stamford TCM. Plant and soil characteristics affected by biofertilizers from rocks and organic matter inoculated with diazotrophic bacteria and fungi that produce chitosan. Journal of soil science and plant nutrition. 2013;13(3):592–603. doi:10.4067/S0718-95162013005000047
16. Agbodjato NA, Noumavo PA, Adjanohoun A, Agbessi L, Baba M . Synergistic Effects of Plant Growth Promoting Rhizobacteria and Chitosan on In Vitro Seeds Germination, Greenhouse Growth, and Nutrient Uptake of Maize (Zea mays L.). Biotechnology Research International. 2016;2016:1–11. doi:10.1155/2016/7830182
17. Clavijo MJA, Bhakta M, Gezan SA, Boote KJ, Vallejos CE. From flower to seed: identifying phenological markers and reliable growth functions to model reproductive development in the common bean (Phaseolus vulgaris L.): Flower to seed: reproductive growth of P . vulgaris. Plant, Cell & Environment. 2013;36:2046–2058. doi:10.1111/pce.12114
18. Shibghatallah MHB, Khotimah SN, Suhandono S, Viridi S, Kesuma T. Measuring leaf chlorophyll concentration from its color: A way in monitoring environment change to plantations. In: AIP Conference Proceedings. AIP; 2013. p. 210–3.
19. Zhao D, Tao J. Recent advances on the development and regulation of flower color in ornamental plants. Frontiers in Plant Science. 2015;261:1–13. doi:10.3389/fpls.2015.00261
20. Mondal MMA, Malek MA, Puteh AB, Ismail MR. Foliar application of chitosan on growth and yield attributes of mungbean (Vigna radiata (L.) Wilczek). Bangladesh Journal of Botany. 2013;42(1):179–83.
21. Salachna P, Zawadzińska A. Effect of chitosan on plant growth, flowering and corms yield of potted freesia. Journal of Ecological Engineering. 2014;15(3):97–102.
22. Mahdavi B. Effects of Priming Treatments on Germination and Seedling Growth of Anise (Pimpinella anisum L.). Agriculture Science Developments. 2016;5(3):28–32. doi:10.21828/ASD-05-03-001
23. Malerba M, Cerana R. Chitosan Effects on Plant Systems. International Journal of Molecular Sciences. 2016;17(7):996. doi:10.3390/ijms17070996
24. Yin H, Du Y, Dong Z. Chitin Oligosaccharide and Chitosan Oligosaccharide: Two Similar but Different Plant Elicitors. Frontiers in Plant Science. 2016;7:522. doi:10.3389/fpls.2016.00522
25. Chookhongkha N, Miyagawa S, Jirakiattikul Y, Photchanachai S. Chili growth and seed productivity as affected by chitosan. In: Proceedings of the International Conference on Agriculture Technology and Food Sciences (ICATFS’2012), Manila, Philippines. 2012. p. 17–8.
26. Zeng D, Luo X, Tu R. Application of Bioactive Coatings Based on Chitosan for Soybean Seed Protection. International Journal of Carbohydrate Chemistry. 2012;2012:1–5. doi:10.1155/2012/104565
27. Khan WM, Prithiviraj B, Smith DL. Effect of foliar application of chitin and chitosan oligosaccharides on photosynthesis of maize and soybean. Photosynthetica. 2002;40(4):621–4. doi:10.1023/A:1024320606812
28. Rodríguez ABF, Costales D, Peña DG, Morales D, Mederos Y, Jerez E, et al. Chitosans of different molecular weight enhance potato (Solanum tuberosum L.) yield in a field trial. Spanish journal of agricultural research. 2017;15(1):25.
29. Hanafy AAH, Aboul Ella NMR, Allam HA, El Wakil AF. Effect of pre-harvest chitosan foliar application on growth, yield and chemical composition of Washington navel orange trees grown in two different regions. African Journal of Biochemistry Research. 2016;10(7):59–69. doi:10.5897/AJBR2016.0908
30. Bistgani Z E, Siadat SA, Bakhshandeh A, Pirbalouti A G, Hashemi M. Interactive effects of drought stress and chitosan application on physiological characteristics and essential oil yield of Thymus daenensis Celak. The Crop Journal. 2017;5(5):407–15. doi:10.1016/j.cj.2017.04.003
31. Ponce M, Fe C, Ortiz R, Moya C. Incasoy-24 E Incasoy-27: Nuevas Variedades De Soya Para Las Condiciones Climaticas De Cuba. Cultivos Tropicales. 2003;24(3):49.
32. Chacón A, Alemán R, Barreda A, Colás A, Rodríguez G, Cardoso S. Influencia de la época de siembra sobre el crecimiento y desarrollo de tres cultivares de soya [Glycine max (L.) Merr.]. Centro Agrícola. 2009;36(1):33–9.
33. Maqueira L, Torres W, Roján O, Pérez S, Toledo D. Respuesta del crecimiento y rendimiento de cuatro cultivares de soya (Glycine max (L.) Merril) durante la época de frío en la localidad de los palacios. Cultivos Tropicales. 2016;37(4):98–104. doi:10.13140/RG.2.2.17255.65447
Recibido: 01/12/2017
Aceptado: 30/04/2018
Dra.C. Daimy Costales-Menéndez. Instituto Nacional de Ciencias Agrícolas (INCA), carretera San José-Tapaste, km 3½, Gaveta Postal 1, San José de las Lajas, Mayabeque, Cuba. CP 32700. Email: daimy@inca.edu.cu