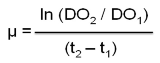
ComunicaciÓn corta
Efecto de diferentes fuentes de carbono sobre el crecimiento de un aislado de rizobio
Effect of different carbon sources on the growth of a rhizobia strain
Ms.C. Ionel Hernández-Forte, Dr.C. María C. Nápoles-García
Instituto Nacional de Ciencias Agrícolas (INCA), carretera San José-Tapaste, km 3½, Gaveta Postal 1, San José de las Lajas, Mayabeque, Cuba. CP 32700
Resumen
El conocimiento de las necesidades nutricionales de los rizobios es importante para comprender su comportamiento en la rizosfera y en la producción de biofertilizantes. El objetivo de esta investigación fue determinar el efecto de diferentes fuentes de carbono sobre el crecimiento de un aislado de rizobio. Rhizobium sp. S11 se cultivó en cinco fuentes de carbono. Su crecimiento se determinó mediante la medición de la densidad óptica (DO) y la velocidad específica de crecimiento (µ). El mayor crecimiento de Rhizobium sp. S11 se obtuvo en el medio con manitol. Las mayores µ se obtuvieron en los medios con manitol, glucosa y glicerol. Estos estudios constituyen la base para una mejor comprensión del comportamiento de Rhizobium sp. S11 en la rizosfera. Además brinda herramientas para el diseño y la optimización de medios de cultivo que permitan incrementar la viabilidad y concentración de este microorganismo en futuros inoculantes.
Palabras clave: caracterización, Rhizobium, multiplicación, carbohidratos.
ABSTRACT
Knowledge of the nutritional needs of rhizobia is important for understanding their behavior in the rhizosphere and in the biofertilizers production. The objective of this research was to determine the effect of different carbon sources on the growth of a rhizobium isolate. On five carbon sources Rhizobium sp. S11 was grown. Its growth was determinated by optical density (OD) measuring and the specific growth rate (μ). The highest growth of Rhizobium sp. S11 was obtained on the medium with mannitol. The highest μ were obtained in the media with mannitol, glucose and glycerol. These studies are the basis for a better understanding of the Rhizobium sp. S11 behavior in the rhizosphere. It also provides tools for the design and optimization of culture media to increase the viability and concentration of this microorganism in future inoculants.
Key words: characterization, Rhizobium, multiplication, carbohydrates.
INTRODUCCIÓN
Los rizobios se estudian fundamentalmente por la simbiosis que realizan con las plantas pertenecientes a la familia Leguminosae (1,2). Estos microorganismos se emplean como porción activa de inoculantes que incrementan los rendimientos de numerosos cultivos de importancia económica (3,4). El empleo de biofertilizantes a base de rizobios en la agricultura, además, disminuye la aplicación de fertilizantes minerales y la contaminación de los ecosistemas (5).
La sobrevivencia de los rizobios en el suelo y la rizosfera depende, en alguna medida, de su capacidad de extraer energía de las diferentes fuentes de carbono disponibles durante todas las etapas de su ciclo de vida: como microorganismos de vida libre, durante el proceso de infección del hospedero y como bacteroides en el interior de los nódulos donde realizan la Fijación Biológica del Nitrógeno (6). Los estudios nutricionales de estos microorganismos brindan herramientas de gran importancia para la confección de medios de cultivo adecuados, aspecto de gran interés durante la elaboración de los biofertilizantes.
El diseño de medios de cultivo debe tener en cuenta los requerimientos nutricionales de estos microorganismos mediante la adición de los nutrientes en la forma y la proporción adecuadas. El estudio de las fuentes de carbono que emplean microorganismos heterótrofos como los rizobios permite una mayor comprensión de su ecología y su comportamiento durante la producción industrial de inoculantes (7) .
La elección de la fuente de carbono óptima constituye uno de los aspectos fundamentales para elaborar inoculantes con elevada viabilidad y concentración bacterianas (8). Estos requisitos garantizan la efectividad del inoculante en el campo. Las fuentes de carbono más empleadas son los alcoholes y los hidratos de carbono, fundamentalmente mono y disacáridos.
El medio estándar para el cultivo de los rizobios incluye manitol, sacarosa o glicerol como únicas fuentes de carbono. Estos garantizan la multiplicación de los rizobios con una fuente de nitrógeno adecuada y bajo determinados parámetros de pH y temperatura (9). El objetivo de esta investigación fue determinar el efecto de diferentes fuentes de carbono sobre el crecimiento de un aislado de rizobio.
MATERIALES Y MÉTODOS
Material microbiano
Un aislado de rizobio denominado Rhizobium sp. S11 se empleó en este estudio. El microorganismo provino de nódulos de soya (Glyxine max L.) ypertenece al cepario del Laboratorio de Bacteriología del Departamento de Fisiología y Bioquímica Vegetal del Instituto Nacional de Ciencias Agrícolas.
Crecimiento bacteriano en diferentes fuentes de carbono
Pre cultivos líquidos del aislado bacteriano se prepararon en erlenmeyers de 100 mL de volumen, que contenían 20 mL de medio líquido Extracto de Levadura-Manitol (LM) (10). Para ello; una asada del microorganismo, conservado en tubos con el mismo medio sólido a 4 oC, se colocó en los erlenmeyers y estos se mantuvieron en condiciones de agitación a 150 rpm, durante 16 h a 28 + 1 0C.
Diez mililitros de los pre cultivos se centrifugaron a 10 000 rpm durante 10 min. Se desechó el sobrenadante y se resuspendió el pellet en 10 mL de medio LM estéril y carente de la fuente de carbono que tradicionalmente se emplea en este medio (manitol). La densidad óptica de las suspensiones celulares se ajustó a 0,25 a una longitud de onda de 600 nm, en espectrofotómetro (GENESYS 20).
Las suspensiones celulares se emplearon para inocular frascos erlenmeyers de 250 mL de volumen, que contenían 50 mL de medio LM líquido. Este medio se suplementó individualmente con las siguientes fuentes de carbono a una concentración de 10,1 g L-1: manitol; glucosa; galactosa; lactosa; glicerol. Los cultivos se mantuvieron en condiciones de agitación a 150 rpm, durante 24 h a 28+1 0C. La pureza de los cultivos bacterianos se comprobó mediante Tinción de Gram.
El crecimiento de Rhizobium sp. S11 se evaluó cada cuatro horas hasta las 24 horas. Para ello se midió la absorbancia de los cultivos a una longitud de onda de 600 nm. Además, se calculó la velocidad específica de crecimiento μ (h-1) (11) en la fase logarítmica o de crecimiento exponencial según la expresión:
Se utilizó un diseño completamente aleatorizado, en el cual se colocaron tres repeticiones por tratamiento. Los datos de la multiplicación celular se sometieron a la prueba de normalidad y homogeneidad de varianza. Se aplicó análisis de varianza de clasificación simple, utilizando el Test de comparación de medias de Tukey (p<0,05) (12). Todos los gráficos se elaboraron en el programa SigmaPlot 2001.
RESULTADOS
El comportamiento y la velocidad específica de crecimiento de Rhizobium sp. S11 en el medio LM con diferentes fuentes de carbono se representa en la figura.
Rhizobium sp. S11 presentó el mayor crecimiento en el medio LM con manitol como fuente de carbono, desde las ocho hasta las 24 horas. En los medios suplementados con manitol y glicerol, como únicas fuentes de carbono, no se observaron diferencias significativas en el crecimiento de este microorganismo a las cuatro horas de cultivo.
El crecimiento de Rhizobium sp S11 mostró diferencias significativas entre todas las fuentes de carbono a las 12 y 16 horas. Sin embargo, a partir de las 20 horas de cultivo no se observaron diferencias en el crecimiento de este microorganismo entre los medios suplementados con glucosa y con glicerol.
Rhizobium sp. S11 presentó la mayor velocidad específica de crecimiento en el medio LM con manitol. Sin embargo, no se observaron diferencias significativas de esta variable entre los medios suplementados con glucosa, galactosa y con glicerol. La lactosa produjo la menor velocidad específica de crecimiento del microorganismo.
DISCUSIÓN
Rhizobium sp. S11 creció en todos los azúcares que se estudiaron. El empleo de diferentes compuestos orgánicos por los microorganismos constituye una ventaja ecológica pues le permite contar con fuentes de carbono alternativas para multiplicarse y mantenerse viable en la rizosfera (7).
El manitol propició el mayor crecimiento de Rhizobium sp. S11 a partir de las ocho horas de cultivo. Resultados similares se obtuvieron por numerosos autores (13). Este compuesto es una de las fuentes de carbono que más se emplean para el crecimiento de los rizobios de la familia Rhizobiaceae, a escala de laboratorio y de producción de inoculantes (14). Rhizobium sp. S11 pertenece a la familia Rhizobiaceae. Esta agrupa a los géneros Rhizobium, Ensifer y Shinella (15).
El empleo de manitol como fuente de carbono en el medio de cultivo incrementa la producción de polihidroxibutiratos (PHB) por algunas cepas de rizobios (16). Este polímero es biodegradable por lo que constituye una alternativa en la sustitución de los plásticos recalcitrantes provenientes de la industria petroquímica (17). El elevado crecimiento de Rhizobium sp. S11 en el medio suplementado con manitol pudiera ser el punto de partida para estudiar las potencialidades de este aislado bacteriano en la producción de PHB.
El glicerol y la glucosa produjeron también un elevado crecimiento de Rhizobium sp. S11. Resultados similares se obtuvieron con Rhizobium leguminosarum bv. trifolii (18). El glicerol ejerce un efecto positivo en la competitividad de los rizobios durante la ocupación del nódulo radical de las leguminosas (19) y en la producción de exopolisacáridos (EPS) (18). Otros autores corroboran el papel de la glucosa (en forma de glucosa 6-fosfato) como uno de los precursores principales de los EPS en los rizobios (20). Los EPS constituyen uno de los determinantes de la simbiosis rizobio-leguminosa (21).
Estos compuestos participan, además, en la formación de biopelículas, la recolección de nutrientes y en la protección contra algunos estreses abióticos (22). El empleo de glicerol y glucosa por Rhizobium sp. S11 no sólo le permitiría un adecuado crecimiento en la rizosfera, sino una mayor adaptación a las condiciones abióticas presentes en el suelo.
La lactosa produjo el menor crecimiento de Rhizobium sp. S11. Este azúcar es un disacárido con un único transportador en la membrana citoplasmática de los rizobios por lo que no se degrada en sus monómeros constituyentes antes de penetrar al citoplasma celular (23). Esto pudiera explicar la ausencia de un comportamiento diáuxico del microorganismo estudiado en presencia de lactosa como única fuente de carbono.
Rhizobium sp. S11 presentó una menor velocidad específica de crecimiento en lactosa que en el medio suplementado con los monómeros estructurales de este azúcar (glucosa y galactosa). La producción por el microorganismo de una β-galactosidasa, enzima que degrada el enlace entre ambos monómeros (24) pudiera explicar, en alguna medida, este comportamiento. La glucosa y la galactosa entrarían directamente a la vía de Entner–Doudoroff para oxidarse hasta piruvato y gliceraldehido 3-fosfato (6). Sin embargo, es necesario realizar estudios moleculares más profundos para corroborar esta hipótesis y determinar el resto de factores que influyen en una velocidad específica de crecimiento menor de este microorganismo en presencia de lactosa.
CONCLUSIONES
Rhizobium sp. S11 constituye un microorganismo que presenta ciertas potencialidades desde el punto de vista nutricional porque emplea diferentes fuentes de carbono para su crecimiento. Su capacidad para multiplicarse considerablemente en presencia de manitol, glucosa y glicerol puede aprovecharse para el diseño de medios de cultivo más económicos.
El empleo de subproductos agrícolas nacionales que contengan estos compuestos pudiera constituir una alternativa que permitan disminuir los costos en la producción de inoculantes para el cultivo de la soya.
RECOMENDACIONES
Caracterizar desde el punto de vista químico algunos de los subproductos agrícolas más abundantes en el país.
Emplear aquellos, con relativamente altos porcentajes de manitol, glucosa y glicerol, en la formulación de medios de cultivo para el crecimiento de Rhizobium sp S11.
Se recomienda además, realizar ensayos de inoculación de Rhizobium sp. S11 en plantas de soya para determinar el efecto del medio de cultivo sobre la nodulación y el crecimiento de estas plantas.
BIBLIOGRAFÍA
1. Suzaki T, Yoro E, Kawaguchi M. Leguminous Plants: Inventors of Root Nodules to Accommodate Symbiotic Bacteria. In: International Review of Cell and Molecular Biology [Internet]. Elsevier; 2015 [cited 2018 Jun 4]. p. 111–58. doi:10.1016/bs.ircmb.2015.01.004
2. Nouwen N, Arrighi JF, Cartieaux F, Chaintreuil C, Gully D, Klopp C, et al. The role of rhizobial (NifV) and plant (FEN1) homocitrate synthases in Aeschynomene/photosynthetic Bradyrhizobium symbiosis. Scientific Reports. 2017;7(1):439–48. doi:10.1038/s41598-017-00559-0
3. Hungria M, Araujo RS, Júnior S, Barbosa E, Zilli JÉ. Inoculum Rate Effects on the Soybean Symbiosis in New or Old Fields under Tropical Conditions. Agronomy Journal. 2017;109(3):1106-12. doi:10.2134/agronj2016.11.0641
4. Nawaz F, Khan N, Shah JA, Khan A, Liaqat A, Ullah S, et al. Yield and yield components of chickpea as affected by various levels of FYM and rhizobium inoculation. Pure and Applied Biology. 2017;6(1):346–51. doi:10.19045/bspab.2017.60033.
5. Adeyeye AS, Togun AO, Olaniyan AB, Akanbi WB. Effect of Fertilizer and Rhizobium Inoculation on Growth and Yield of Soyabean Variety (Glycine max L. Merrill). Advances in Crop Science and Technology. 2017;05(01):1–9. doi:10.4172/2329-8863.1000255
6. Geddes BA, Oresnik IJ. Physiology, genetics, and biochemistry of carbon metabolism in the alphaproteobacterium Sinorhizobium meliloti. Canadian journal of microbiology. 2014;60(8):491–507. doi:10.1139/cjm-2014-0306.
7. Madigan MT, Martinko JM, Parker J. Brock biología de los microorganismos. Décima edición. United States of America: Pearson, Prentice Hall Hispanoamericana; 2011. 1011 p.
8. Singleton P, Keyser H, Sande E. Development and evaluation of liquid inoculants. In: Herridge D, editor. Inoculants and nitrogen fixation of legumes in Vietnam. Canberra,Australia: Australian Centre for International Agricultural Research Proceedings; 2002. p. 52–66.
9. Gaurav K, Singh AK, Singh G. Spent Wash as an Alternative Medium for Growth of Rhizobium. Journal of Academia and Industrial Research (JAIR). 2016;5(6):81–4.
10. Vincent JM. A Manual for the Practical Study of the Root-Nodule Bacteria. In: International Programme Handbook [Internet]. Oxford, England: Blackwele scientific publications; 1970 [cited 2018 Jun 4]. p. 440–440. Available from: https://onlinelibrary.wiley.com/doi/abs/10.1002/jobm.19720120524
11. Maier RM. Bacterial growth. In: Maier R, Pepper I, Gerba C, editors. Environmental Microbiology. 2 edition. Amsterdam ; Boston: Academic Press; 2008. p. 38–56.
12. Sigarroa A. Biometría y diseño experimental. La Habana, Cuba: Editorial Pueblo y Educación; 1985. 328 p.
13. Ouslim S, Merabet C, Boukhatem Z, Bouchentouf L, Bekki A. Phenotypic And Symbiotic Diversity, Of Nodulating Rhizobia Associated With Bean (Vicia faba) In West Algeria. International Journal of Technology Enhancements and Emerging Engineering Research. 2015;3(9):130–8.
14. Singh AK, Singh G, Bhat RP. Effects of salt stress on cell surface properties and symbiotic performance of root nodulating bacteria. UK J. Pharmaceut. Biosci. 2015;3(1):23–9. doi:10.20510/ukjpb/3/i1/89222
15. Berrada H, Fikri BK. Taxonomy of the Rhizobia: Current Perspectives. British Microbiology Research Journal. 2014;4(6):616–639. doi:2231-0886
16. Kıvanc M, Dombaycı N. Production of Poly-Β-Hydroxybutyric Acid by Rhizobium Sp. Fresenius Environmental Bulletin. 2016;25(5):1305–11.
17. Lathwal P, Nehra K, Singh M, Jamdagni P, Rana JS. Optimization of Culture Parameters for Maximum Polyhydroxybutyrate Production by Selected Bacterial Strains Isolated from Rhizospheric Soils. Polish journal of microbiology. 2015;64(3):227–39.
18. Janczarek M, Rachwał K, Cieśla J, Ginalska G, Bieganowski A. Production of exopolysaccharide by Rhizobium leguminosarum bv. trifolii and its role in bacterial attachment and surface properties. Plant and Soil. 2015;388(1–2):211–27. doi:10.1007/s11104-014-2320-5
19. Vanderlinde EM, Hynes MF, Yost CK. Homoserine catabolism by Rhizobium leguminosarum bv. viciae 3841 requires a plasmid-borne gene cluster that also affects competitiveness for nodulation: R. leguminosarum genes for homoserine catabolism. Environmental Microbiology. 2014;16(1):205–17. doi:10.1111/1462-2920.12196
20. Gosselin I, Wattraint O, Riboul D, Barbotin JN, Portais JCh. A deeper investigation on carbohydrate cycling in Sinorhizobium meliloti. FEBS Letters. 2001;499(1–2):45–9. doi:10.1016/S0014-5793(01)02518-2
21. Muszyński A, Heiss C, Hjuler CT, Sullivan JT, Kelly SJ, Thygesen MB, et al. Structures of Exopolysaccharides Involved in Receptor-mediated Perception of Mesorhizobium loti by Lotus japonicus. Journal of Biological Chemistry. 2016;291(40):20946–61. doi:10.1074/jbc.M116.743856
22. Jaszek M, Janczarek M, Kuczynski K, Piersiak T, Grzywnowicz K. The response of the Rhizobium leguminosarum bv. trifolii wild-type and exopolysaccharide-deficient mutants to oxidative stress. Plant and Soil. 2014;376(1–2):75–94. doi:10.1007/s11104-013-1959-7
23. Glenn AR, Dilworth MJ. The uptake and hydrolysis of disaccharides by fast-and slow-growing species of Rhizobium. Archives of Microbiology. 1981;129(3):238–9. doi:10.1007/BF00425257
24. Niel C, Guillaume JB, Bechet M. Mise en évidence de deux enzymes présentant une activité β-galactosidasique chez Rhizobium meliloti. Canadian Journal of Microbiology. 1977;23(9):1178–81. doi:10.1139/m77-177
Recibido: 06/12/2017
Aceptado 01/05/ 2018
Ms.C. Ionel Hernández-Forte. Instituto Nacional de Ciencias Agrícolas (INCA), carretera San José-Tapaste, km 3½, Gaveta Postal 1, San José de las Lajas, Mayabeque, Cuba. CP 32700. Email: ionel@inca.edu.cu