ARTÍCULO ORIGINAL
Respuesta de Stevia rebaudiana Bertoni a la aplicación del producto bioactivo Pectimorf ®
Response of Stevia rebaudiana Bertoni to the application of bioactive product Pectimorf ®
Yadira Almaguer-Ricardo, Elein Terry-Alfonso, Dianevys González-Peña Fundora
Instituto Nacional de Ciencias Agrícolas (INCA), carretera San José-Tapaste, km 3½, Gaveta Postal 1, San José de las Lajas, Mayabeque, Cuba. CP 32 700
RESUMEN
Stevia rebaudiana Bertoni es una planta arbustiva que posee propiedades edulcorantes en sus hojas y que puede ser utilizada con fines medicinales. La calidad y el vigor de los esquejes resultan esenciales para el posterior trasplante y aclimatación del cultivo en la fase de vivero, por lo que es importante encontrar alternativas que garanticen un eficiente enraizamiento. El objetivo del trabajo fue evaluar el efecto del Pectimorf ® en el crecimiento de esquejes de Stevia en la fase de vivero. Los esquejes se embebieron durante dos tiempos diferentes (30 y 60 minutos) a las concentraciones de 10 y 20 mg L-1 de Pectimorf ® . Como control se emplearon la hormona convencional ácido indolacético (AIA) (30 minutos a 1 mg L-1) y el agua como testigo absoluto. Se realizaron evaluaciones desde los 20 y hasta los 50 días en semillero. La adición de Pectimorf ® a la concentración de 20 mg L-1, incrementó el número de raíces y hojas, el diámetro del tallo, la masa seca de hojas y tallos, así como los grados Brix en hojas de la zona apical de las plantas. El efecto del tiempo de imbibición del Pectimorf ® a esta concentración dependió de la variable evaluada.
Palabras clave: enraizamiento, esquejes, bioproductos, vivero.
ABSTRACT
Stevia rebaudiana Bertoni is a shrub that has sweetening properties on its leaves and can be used for medicinal purposes. The quality and vigor of the cuttings are essential for the later transplanting and acclimatization of the crop in the nursery phase, reason why it is important to find alternatives that guarantee an efficient rooting. The objective of the work was to evaluate the effect of Pectimorf ® on the growth of Stevia cuttings in the nursery stage. The cuttings were soaked for two different times (30 and 60 minutes) at 10 and 20 mg L-1 concentrations of Pectimorf ® . As a control the conventional hormone indoleacetic acid (IAA) (30 minutes at 1 mg L-1) and water were used as absolute control. Evaluations were performed from 20 to 50 days in the nursery. The addition of Pectimorf ® to the concentration of 20 mg L-1 increased the roots and leaves number, stem diameter, dry mass of leaves and stems, as well as Brix degrees in leaves of the apical zone on plants. The effect of Pectimorf ® imbibition time at this concentration depended on the evaluated variable.
Key words: rooting, cuttings, bioproducts, nursery.
INTRODUCCIÓN
Las hojas frescas de Stevia poseen esteviósido y rebaudiósido, ambos son glucósidos que le atribuyen el sabor dulce que puede ser hasta 300 veces más que la sacarosa, se utiliza como sustituto de los edulcorantes sintéticos, además, no aportan calorías. Por ello puede ser empleada en la industria alimenticia y farmacéutica de varios países para endulzar diversos productos como sustituto de los edulcorantes sintéticos. Esta planta tiene otras funciones benéficas en la salud, ayuda a regular la presión arterial, a eliminar las toxinas, es antimicrobiana y antioxidante y tiene propiedades digestivas, diuréticas y antiácidas (1).
Por tanto, se impone desde el punto de vista fitotécnico, profundizar el estudio y perfeccionar la tecnología de esta especie en las condiciones actuales de Cuba; sin embargo, pocos son los estudios desde el punto de vista agronómico, de ahí la novedad en las diferentes líneas de investigación a desarrollar (2).
Considerando que la Stevia es una planta de reproducción asexual, surge la necesidad de producir un número elevado de esquejes para lograr su multiplicación y poder contar con plantas para suplir las demandas actuales de empresas y productores interesados en su cultivo.
Para lograrlo, se utilizan por lo general, productos de naturaleza química de alto costo a nivel mundial como lo es el ácido indolacético (AIA); por lo que, se impone encontrar alternativas que garanticen un eficiente enraizamiento y un efecto positivo en el crecimiento y el desarrollo de las plantas.
En este sentido, entre los productos de origen vegetal con atributos para la agricultura, se encuentra el Pectimorf ® , producto obtenido a partir de una mezcla de oligogalacturónidos. Los trabajos consultados refieren su capacidad de influir en diferentes procesos fisiológicos que estimulan el crecimiento y el desarrollo de las plantas (3). De acuerdo a estos antecedentes, el presente trabajo tuvo como objetivo evaluar el producto Pectimorf ® como estimulador del enraizamiento y crecimiento de plantas de Stevia en fase de vivero.
MATERIALES Y MÉTODOS
La investigación se desarrolló en áreas experimentales del Instituto Nacional de Ciencias Agrícolas (INCA), situado en el municipio de San José de las Lajas, provincia Mayabeque, Cuba, en un periodo que abarca del 14 de julio de 2014 al 9 de enero de 2015.
El sustrato que se empleó fue una mezcla de abono orgánico (estiércol vacuno) y cascarilla de arroz, en proporción 3:1 (4). La Tabla I muestra las características químicas del sustrato que se empleó. El pH y los cationes intercambiables se encuentran en el rango adecuado para el desarrollo del cultivo (5).
Los análisis se realizaron en el laboratorio de Biofertilizantes y Nutrición de las plantas del INCA, según la metodología descrita (6). El ensayo se montó con plantas de Stevia, libres de plagas. Teniendo en cuenta la uniformidad de los esquejes, se utilizaron propágulos de 10 cm de largo con cinco pares de hojas. Los esquejes fueron plantados en bandejas de 70 alveolos con 5,5 cm de diámetro y una profundidad de 4,5 cm. Se empleó el Pectimorf ® obtenido por el Grupo de Productos Bioactivos del Departamento de Fisiología y Bioquímica Vegetal del INCA, a partir de la degradación enzimática de la pectina de la corteza de los frutos cítricos.
Este tiene como principio activo una mezcla de oligogalácturónidos de origen péctico con grado de polimerización entre 9 y 16 (7), lo cual le proporciona entre sus ventajas adicionales, solubilidad en el medio acuoso.
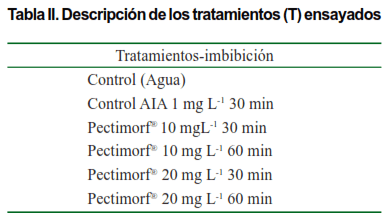
Los esquejes se embebieron en dos concentraciones y dos tiempos de imbibición. Las concentraciones utilizadas fueron de 10 mg L-1 y 20 mg L-1 y el tiempo de imbibición fue de 30 y 60 minutos. Se utilizó como control agua destilada y el AIA (ácido indolacético) a la concentración de 1 mg L-1 durante 30 minutos, dando lugar a seis tratamientos (Tabla II), bajo un diseño experimental completamente aleatorizado, constituyendo 15 plantas las repeticiones por cada tratamiento en estudio.
A las plantas de cada tratamiento, a los 20 y 40 días después de la imbibición (DDI), se les realizaron las siguientes evaluaciones:
Número de raíces (U): conteo visual de las raíces presentes en cada uno de los tratamientos. Sólo se determinó a los 20 DDI.
Longitud radical (cm): se midió la raíz principal con una regla graduada.
Número de hojas por plántula (U): por conteo visual, la altura de las plántulas (cm), se midió con regla graduada, desde el cuello de la raíz hasta la axila de la hoja más joven.
Diámetro del tallo de las plántulas (mm): se determinó con un pie de rey, a partir de dos centímetros por encima del cuello de la raíz.
Masa seca de las plántulas (g): secado en estufa (BrBOXUN) a una temperatura de 700 °C durante siete días hasta masa constante. Se pesó en balanza analítica (Sartorius).
Los datos obtenidos, se analizaron mediante un ANOVA de clasificación simple. Las medias resultantes se compararon con la Prueba de Rangos Múltiples de Duncan para p≤0,05 cuando existieron diferencias significativas entre los tratamientos. Se empleó el programa Statgraphics Centurión-2013 bajo el sistema operativo Windows 7.
RESULTADOS Y DISCUSIÓN
Una de las variables más importantes en la plantación de esquejes lo constituye el número de raíces que sean capaces de formar, ya que de ello dependerá en parte, el anclaje en el suelo al momento del trasplante. En la Figura 1 se puede observar que a los 20 días posteriores a la imbibición de los esquejes (momento del trasplante), aquellos que se embebieron en 20 mg L-1 de Pectimorf ® , durante 60 minutos, poseían un mayor número de raíces, valor que difirió estadísticamente de los restantes tratamientos y, sobre todo, del que incluyó el AIA, hormona estimuladora del crecimiento vegetal. El menor número de raíces se obtuvo con el tratamiento control, lo que evidencia la necesidad de utilizar un producto estimulador del crecimiento de las plantas.
En concordancia con este resultado, también las potencialidades del Pectimorf ® como en raizador, ha mostrado capacidad de inducir la formación de raíces adventicias en peciolos de violeta africana y esquejes de clavel, obteniendo un notable efecto sobre la formación de raíces, con valores de hasta 12 unidades, tras 20 días de la imbibición y, por tanto, un mayor éxito en el desarrollo de las plantas (8). En cuanto a los reguladores del crecimiento (compuestos sintéticos sus hormonas vegetales) estos condicionan el desarrollo de los procesos fisiológicos en el esqueje y estimulan la iniciación radical (4).
La aplicación práctica de estos productos tiene como objetivo la estimulación de la emisión de raíces, que garantiza la homogeneidad del enraizado; acelerar el enraizamiento y aumentar el porcentaje de supervivencia.
Por otra parte, en la reproducción por esquejes, la inducción de enraizamiento comprende complejos procesos anatómicos y fisiológicos, en los que juegan un papel importante la acción combinada de las auxinas y los cofactores de enraizamiento que se sintetizan en las hojas y yemas (9).
Finalmente, las fases de iniciación y ramificación radical están reconocidas anatómicamente por el desarrollo de callo en los esquejes y la emisión de raíces laterales en primordios desarrollados (10).Ambas etapas tienen marcada influencia en la propagación por estacas (11). Desde el punto de vista productivo marcan el tiempo inicial y final para la realización del trasplante a bolsa o a sitio definitivo. El hecho de que los esquejes sin aplicación de producto, o sea, esquejes embebidos en agua, también emitan raíces, sugiere la expresión de su capacidad intrínseca para esta actividad fisiológica; capacidad ya reconocida, al señalar que en los esquejes también se encuentran centros productores de auxinas, como los ápices de las hojas y los tallos y las yemas axilares.
La auxina en estos centros puede transportarse como auxina libre, sin actividad fisiológica, por los conductos del esqueje, para actuar en los sitios de mayor demanda (12).
En la Figura 2 se muestra la longitud de las raíces evaluada en diferentes momentos del crecimiento de las plantas. La longitud de las raíces fue mayor con la aplicación del AIA y el Pectimorf ® comparado con la imbibición de esquejes en agua. El Pectimorf ® , a la concentración de 10 mg L-1 en la 2da y 3ra no alcanzó valores similares a los obtenidos por la aplicación de la hormona tradicional (AIA); y con la aplicación de 20 mg L-1 no se observaron diferencias significativas en relación con el AIA (Figura 2).
Estos resultados están en concordancia con estudios realizados en el cultivo de la guayaba con la dosis de 20 mg L-1 de Pectimorf ® , los cuales muestran que este producto puede sustituir totalmente a los reguladores del crecimiento tradicionales como el AIA y en muchos de los casos, se obtienen resultados superiores (4).
La hoja de este cultivo es el órgano con mayor contenido de edulcorante, por lo que es importante contar con un gran número de ellas. Además, tienen gran importancia en la regulación de la capacidad y eficiencia fotosintética de la planta y son optimizadores de la distribución de los asimilatos que constituyen indicadores fundamentales para el incremento de los rendimientos.
En la Figura 3 se puede apreciar que la cantidad de hojas se incrementa sustancialmente, de la primera a la tercera evaluación, como es característico de estas plantas en esta fase. En las dos últimas evaluaciones se denotan diferencias estadísticas entre los diferentes tratamientos. El mayor número de hojas, en el segundo momento evaluado, se obtuvo con la aplicación de 20 mg L-1 de Pectimorf ® durante 30 minutos, con valores superiores y diferentes del resto de los tratamientos; mientras que la concentración menor del producto no indujo un incremento de esta variable en la magnitud obtenida con la hormona tradicional, pero sí fue superior al control.
La altura de las plantas se puede apreciar en la Figura 4, en las cuales se diferenciaron los tratamientos entre sí. Todos los tratamientos indujeron un incremento en la altura en relación al control de agua. En la segunda evaluación, los esquejes que se embebieron durante 60 minutos en ambas concentraciones de Pectimorf ® así como aquellos que se embebieron durante 30 minutos en 20 mg L-1, mostraron mayores valores que los obtenidos por el AIA; sin embargo, en el tercer y cuarto momento de evaluación, la aplicación de la mayor concentración del Pectimorf ® estimuló la altura al mismo nivel que el AIA.
Trabajos realizados con Oligogalacturónidos (OGs) refieren que una posible vía por la cual se incrementa la altura de la planta es debido a que las oligosacarinas pueden estimular la actividad fotosintética; por tanto, hay una mayor ganancia de esqueletos carbonados que pueden ser utilizados para la síntesis de nuevos compuestos, como son las proteínas (13).
El diámetro del tallo es uno de los parámetros clave en la elección de posturas y esquejes para producir plantas en óptimo estado (14). En particular, la aplicación de OGs ha demostrado favorecer esta variable en diferentes cultivos (15). En la Figura 5 se muestran los resultados de la aplicación del Pectimorf ® sobre el diámetro de los esquejes, observándose diferencias significativas solo en las dos últimas evaluaciones, donde las aplicaciones de AIA y Pectimorf ® mostraron incrementos en relación al control.
Resultados similares informaron que al aplicar 20 mg L-1 de PectiMorf® a esquejes de guayaba (Psidium guajava L.), se observan, un incremento de esta variable cuando se combinaba con diferentes soportes como paja de arroz y zeolita (4). En general, se ha demostrado que el Pectimorf ® funciona como un mensajero químico hormonal que regula los mecanismos de crecimiento y diferenciación en diferentes cultivos (16), por lo que el incremento del diámetro del tallo observado puede ser una de las variables sobre las que influya positivamente. Una de las variables más importante a evaluar en los cultivos, es la masa seca de los diferentes órganos de la planta, por la alta correlación que tiene con el crecimiento de las mismas. En la Tabla III se observa el efecto del Pectimorf ® en la masa seca del tallo de las plantas.
En la primera evaluación no se diferenciaron los tratamientos entre sí, contrario a lo ocurrido en la segunda, fundamentalmente, al final del primer ciclo vegetativo (40 DDI), donde la dosis de 20 mg L-1 con 60 minutos de imbibición de Pectimorf ® , logró un incremento de la masa seca en un 100 % en relación al control. Con este resultado se puede inferir que las plantas que recibieron la aplicación de los productos, realizan un mayor aprovechamiento de los nutrimentos y del agua que redunda en la mayor formación de biomasa en el mismo período de tiempo, respecto a las que no reciben ese tratamiento.
Otros resultados mostraron que la aspersión foliar a plantas de palma areca con 2,10 y 20 mg L-1 causó su punto de máxima respuesta vegetal en la dosis de 10 mg L-1 (17).
Mientras que, al emplear el producto para el enraizamiento de dos variedades de guayaba, suprema Roja y Enana Roja Cubana, obtuvieron las mejores respuestas vegetales con 10 y 20 mg L-1 respectivamente (4). En la Tabla IV se muestra la acumulación de materia seca en las hojas, que tuvo un comportamiento similar al del tallo, con la diferencia de que en este caso, el tratamiento Pectimorf ® 20 mg L-1 durante 30 minutos, fue estadísticamente diferente del tratamiento con la auxina, superándolo en un 39 %. Este resultado permite afirmar que este oligogalacturónido es activo biológicamente a la concentración estudiada, lo cual caracteriza este grupo de biomoléculas en una nueva jerarquía hormonal.
La mayor formación de masa seca obtenida en algunos casos con el Pectimorf ® pudiera traducirse en una mayor eficiencia fotosintética de las plantas que conllevaría a incrementos del rendimiento. Los valores de la masa seca de la raíz dan medida de su crecimiento y de su desarrollo al aplicar los diferentes productos. Los resultados presentados en la Tabla V muestran una tendencia similar al comportamiento de las variables relacionadas con masa seca, anteriormente evaluada.
La masa seca de las raíces mostró diferencias significativas en el momento de evaluación, a partir de los 40 DDI, al emplearse los tratamientos de Pectimorf ® y el AIA.
CONCLUSIONES
El mayor enraizamiento de esquejes de Stevia se logra con la dosis de 20 mg L-1 de Pectimorf ® a través de la imbibición de los esquejes, durante 30 y 60 minutos, lo cual incrementó el crecimiento de las plantas durante la fase de vivero.
El producto constituyó una alternativa económicamente viable como sustituto de las hormonas convencionales, como lo es el AIA.
BIBLIOGRAFÍA
1. Hinojosa JJ, Tun A, Canul A, Ruiz C, Rocha JA, Betancur D. Extracción de glucósidos edulcorantes de Stevia rebaudiana Bertoni por métodos de fluidos supercríticos. Journal of Negative and No Positive Results. 2017;2(5):202–9.
2. Palacio E, Hurtado JH, Arroyave JD, Cardona M, Martínez J. Edulcorantes naturales utilizados en la elaboración de chocolates. Biotecnología en el Sector Agropecuario y Agroindustrial. 2017;15(2):142–52. doi:10.18684/BSAA(15)142-152.
3. Izquierdo H. Empleo de nuevas sustancias como reguladores del crecimiento en la micro propagación del banano (Musa spp) clon ´FHIA-18´ (AAAB). [Tesis de Doctorado]. [Mayabeque]: Instituto Nacional de Ciencias Agrícolas; 2013. 100 p.
4. Ramos L, Arozarena N, Lescaille J, Cisneros F, Tamayo Y, Castañeda E, et al. Dosis de pectimorf® para enraizamiento de esquejes de guayaba var. Enana Roja Cubana. Revista mexicana de ciencias agrícolas. 2013;4(6):1093–105.
5. Casanova AS. Manual para la producción protegida de hortalizas. Instituto de Investigaciones Hortícolas¨ Liliana Dimitrova¨; 2007.
6. Cabrera JC. Obtención de (1-4) ad-oligogalacturónidos bioactivos a partir de subproductos de la industria citrícola. Tesis en opción al grado de Doctor en Ciencias Químicas. Instituto Nacional de Ciencias Agrícolas, La Habana, Cuba; 1999.
7. Posada-Pérez L, Padrón-Montesinos Y, González-Olmedo J, Rodríguez-Sánchez R, Barbón-Rodriguez R, Norman-Montenegro O, et al. Efecto del Pectimorf® en el enraizamiento y la aclimatización in vitro de brotes de papaya (Carica papaya L.) cultivar Maradol Roja. Cultivos Tropicales. 2016;37(3):50–9. doi:10.13140/RG.2.1.1642.2642
8. Ramos L. Uso de Pectimorf®, fitomas-e inóculos microbianos para el enraizamiento de esquejes y el crecimiento de posturas de guayaba (Psidium guajava L.) ʽenana roja Cubanaʼ [Internet] [Tesis de Doctorado]. [La Habana]: Instituto Nacional de Ciencias Agrícolas (INCA); 2014 [cited 2018 Sep 25]. Available from: https://www.google.com/search?client=firefox-b-ab&ei=T5CqW_OYIsjAzgKYyoSABA&q=Uso+de+Pectimorf%C2%AE%2C+fitomas-+e+in%C3%B3culos+microbianos+para+el+enraizamiento+de+esquejes+y+el+ crecimiento+de+posturas+de+guayaba+%28 Psidiumguajava+L.%29+%CA%BDenana+roja+Cubana%CA%BC+&oq=Uso+de+Pectimorf%C2%AE%2C+fitomas-+e+in%C3%B3culos+microbianos+para+el+enraizamiento+de+esquejes+y+el+crecimiento+de+posturas+de+guayaba+%28Psidiumguajava+L.%29+%CA%BDenana+roja+Cubana%CA%BC+&gs_l=psy-ab.12...16395.16395.0.18019.1.1.0.0.0.0.0.0..0.0....0...1c.1.64.psy-ab..1.0.0....0.rlLT9a7NzMk
9. Doll U, Norambuena C, Sánchez O. Efecto de la aplicación de IBA sobre el enraizamiento de estacas en seis especies arbustivas nativas de la región mediterránea de Chile. Idesia (Arica). 2013;31(3):65–9. doi:10.4067/S0718-34292013000300009
10. Overvoorde P, Fukaki H, Beeckman T. Auxin Control of Root Development. Cold Spring Harbor Perspectives in Biology [Internet]. 2010 [cited 2018 Sep 21];2(6). doi:10.1101/cshperspect.a001537
11. Balaguera HE, Morales I, Almanza PJ, Balaguera WA. El tamaño del cladodio y los niveles de auxina influyen en la propagación asexual de pitaya (Selenicereus megalanthus Haw.). Revista Colombiana de Ciencias Hortícolas. 2010;4(1):33–42.
12. Hernández RM, Diosdado E, Cabrera JC, Coll F. Efecto de los biorreguladores del crecimiento en la embriogénesis somática de mandarina Cleopatra (Citrus reshni Hort. ex Tan.). Cultivos Tropicales. 2010;31(3):32–8.
13. Pérez JL, García L, Veitía N, Bermúdez I, Collado R. Efecto del ácido 2,4-diclorofenoxiacético en la respuesta embriogénica de soya cultivar INCASoy-27. Cultivos Tropicales. 2013;34(3):40–4.
14. Pérez J, Aranguren M, Luzbet R, Reynaldo I, Rodríguez J. Aportes a la producción intensiva de plantas de guayabo (Psidium guajava L.) a partir de esquejes en los viveros comerciales. CitriFrut. 2013;30(2):11–6.
15. Pentón G, Reynaldo I, Martín GJ, Rivera R, Oropesa K. Uso del EcoMic ® y el producto bioactivo Pectimorf® en el establecimiento de dos especies forrajeras. Pastos y Forrajes. 2011;34(3):281–94.
16. Álvarez I, Reynaldo IM. Efecto del Pectimorf® en el índice estomático de plantas de frijol (Phaseolus vulgaris L.). Cultivos Tropicales. 2015;36(3):82–7.
17. Nápoles S, Garza T, Reynaldo IM. Respuesta del cultivo de habichuela (Vigna unguiculata L.) var. Lina a diferentes formas de aplicación del Pectimorf®. Cultivos Tropicales. 2016;37(3):172–7. doi:10.13140/RG.2.1.3698.4566
Recibido: 05/12/2017
Aceptado: 14/09/2018
Yadira Almaguer-Ricardo. Instituto Nacional de Ciencias Agrícolas (INCA), carretera San José-Tapaste, km 3½, Gaveta Postal 1, San José de las Lajas, Mayabeque, Cuba. CP32700. Email: yalmaguer@inca.edu.cu