Translate PaperArtículo originalRespuesta de soya (Glycine max (L) Merr) a la inoculación con Azospirillum y Bradyrhizobium
Mario Alberto-Casas [1] [*]
Susana Fajardo-Molina [2]
Cesar Morcillo-Blanco [2]
Mercedes Fernández-Pascual [2]
[1] Instituto de Investigaciones de la Caña de Azúcar (INICA), carretera CUJAE Km 1½, Rancho Boyeros, CP 19390, La Habana, Cuba
[2] Instituto
de Ciencias Agrarias (ICA-CSIC), Consejo Superior de Investigaciones
Científicas (CSIC), Serrano 115, dpdo., CP 28006 Madrid, España
[*] Autor para correspondencia. marioalbertocasas@gmail.com
RESUMENAzospirillum brasilense
es una bacteria fijadora de nitrógeno y promotora del crecimiento
vegetal con potencial como biofertilizante para plantas leguminosas y no
leguminosas. Cultivos de importancia como la caña de azúcar han sido
inoculados con A. brasilense produciendo incrementos en el
crecimiento y el rendimiento de las cosechas en diferentes suelos y
regiones climáticas. Experimentos en campo realizados en Cuba, de
intercalamiento con caña de azúcar, inoculada con A. brasilense y
soya, produjeron un incremento en la mayoría de los parámetros de
crecimiento de la caña de azúcar, pero se desconocen los efectos de A. brasilense
sobre soya. Este trabajo analiza las alteraciones en el desarrollo de
planta y nódulos, actividad nitrogenasa y colonización por A. brasilense de raíces de soya inoculadas con A. brasilense 8-INICA y Bradyrhizobium japonicum USDA-110. A. brasilense
no produjo modificaciones en la biomasa de la parte aérea de la planta
ni en la actividad nitrogenasa en nódulos. Sin embargo, se produjeron
incrementos en la biomasa de raíces y nódulos con su inoculación. A. brasilense
coloniza la superficie de la raíz de soya mediante adhesión a la capa
mucilaginosa y tiene la capacidad de proliferar y formar microcolonias
en ella. La ruptura causada por la emergencia de raíces secundarias
permitió a la bacteria entrar en los espacios intercelulares y las
diferentes capas del parénquima radicular, produciéndose la
colonización. Estos resultados sugieren que A. brasilense 8-INICA puede vivir como endófito en raíces de soya y podría ser un candidato a inoculante de leguminosas con fines agrícolas.
INTRODUCCIÓNLa
importancia de aumentar los rendimientos de los cultivos en los
sistemas de agricultura de subsistencia, caracterizados por un uso
mínimo de fertilizantes minerales pasa por mejorar las interacciones de
microorganismos beneficiosos-raíz-suelo que conducen a rendimientos más
altos de los cultivos 1. El efecto en las
leguminosas de coinoculación con simbióticos fijadores de nitrógeno y
los géneros no simbióticos que promueven el crecimiento de plantas
(PGPRs), están ganando cada vez más interés dentro de la fijación
biológica de nitrógeno actual y se han propuesto como una nueva
herramienta biotecnológica para mejorar el rendimiento y la
sostenibilidad 2.
A. brasilense
es una rizobacteria promotora del crecimiento de plantas fijadoras de
nitrógeno (PGPR), con un potencial importante como biofertilizante para
plantas leguminosas y no leguminosas. Cultivos de importancia agrícola,
especialmente la caña de azúcar, se han inoculado a menudo con A. brasilense, lo que produce un aumento en los parámetros de crecimiento y rendimiento en diferentes suelos y regiones climáticas 3.
Se han propuesto diferentes mecanismos de acción para explicar la
mejora del crecimiento de las plantas, como la proliferación del sistema
radical 4. La estimulación del
crecimiento, generalmente se debe a la producción de fitohormonas como
las auxinas, citoquininas, giberelinas 5,6. Además, se ha descrito la inducción de la tolerancia al estrés de las plantas y los genes de defensa 7.
La aplicación combinada de bacterias del género Rhizobium o Bradyrhizobium con Azospirillum, produjo un efecto positivo en las leguminosas 8.
El efecto positivo da como resultado nodulación temprana, aumento en el
número de nódulos, actividad de la nitrogenasa y la respiración de la
raíz, así como una mejora general en la absorción de agua y nutrientes
por parte de las raíces. Las características de PGPR de Azospirillum
pueden ser la razón de su efecto sobre las coinoculaciones de
leguminosas, que se relacionarían con la inducción de un mayor número de
pelos radicales infectantes, diferenciados de las células epidérmicas y
un aumento en la secreción de flavonoides que inducen genes nod9.
El
intercalamiento de cultivos es un método sostenible que se utiliza para
maximizar la utilización de los recursos disponibles y podría mejorar
la biodiversidad de los suelos. En suelos tropicales se ha comprobado
que el cultivo intercalado de gramíneas con leguminosas representa un
conjunto de ventajas, entre las cuales podemos destacar, la contribución
del nitrógeno al suelo y la obtención de producciones adicionales de
fibra, grasa y alimentos 10. Además, el intercalamiento de cultivos mejora la resiliencia, la seguridad alimentaria 11 y la nutrición.
En experimentos de campo, en suelos cubanos de intercalamiento de caña de azúcar inoculada con A. brasilense y soya no inoculada10,
se han observado aumentos en la mayoría de los parámetros de
crecimiento de la caña de azúcar, pero no se conocen los efectos
producidos por la inoculación de Azospirillum en la otra planta intercalada. El objetivo de este trabajo fue evaluar, bajo condiciones controladas, el efecto de A. brasilense 8-INICA y B. japonicum
USDA-110 por separado y la coinoculación de los dos microorganismos
sobre la altura de la planta, peso fresco de tallo y raíces, peso seco
de nódulos, así como actividad nitrogenasa en nódulos de las raíces de
soya (Glycine max (L) Merr), con énfasis en la colonización de la raíz de soya por Azospirillum.
MATERIALES Y MÉTODOSCepasA. brasilense cepa 8-INICA aislada de rizosfera de caña de azúcar cv. Ja 60-5 en la provincia de Ciego de Ávila, Cuba 12 cultivada en medio NFb a 28 ºC, 100 rpm y mantenida en caldo BMS 13 con glicerol al 20 % (v/v) a -80 ºC. B. japonicum cepa USDA-110 14
donada por el Centro de Investigación y Formación Agraria Las
Torres-Tomejil (Sevilla, España), cultivada y mantenida en medio Vincent
15.
Crecimiento de las plantas y actividad nitrogenasaLas semillas de soya (Glycine max cv. Williams) se esterilizaron superficialmente en HgCl2
al 0,1 % durante 5 min y luego se lavaron varias veces con agua
destilada estéril. Las semillas se sembraron en frascos Leonard de 1 L
pasados por autoclave llenos de vermiculita estéril y se inocularon con 1
mL de A. brasilense 8-INICA o B. japonicum USDA-110 en suspensiones con concentraciones del orden 108 unidades formadoras de colonias (UFC. mL-1).
Los tratamientos fueron: plantas no inoculadas regadas con una solución
de nitrato de potasio conteniendo 35 ppm de nitrógeno (tratamiento
control); plantas inoculadas solo con A. brasilense 8-INICA; plantas inoculadas solo con B. japonicum
USDA-110 y plantas inoculadas con los dos microorganismos. Los
tratamientos de inoculación se regaron con una solución nutritiva libre
de nitrógeno. Las soluciones nutritivas fueron reemplazadas tres veces
por semana. Las condiciones de la cámara de crecimiento fueron: un
fotoperíodo de 16 h de luz/8h de oscuridad, 25 ºC día/15 ºC de
temperatura nocturna, 58 % de humedad relativa y un nivel de irradiación
de 200 μm m-2 s-1. Se usaron tres réplicas para
plantas inoculadas y no inoculadas. Después de cinco semanas, las
plantas se recolectaron para determinaciones de parámetros de
crecimiento de plantas y para microscopía. Se determinó la altura de la
planta, el peso fresco de los tallos y las raíces, el peso seco de los
nódulos y la actividad nitrogenasa en los nódulos. La actividad
nitrogenasa se midió mediante el ensayo de reducción de acetileno (ARA)
en raíces noduladas de plantas inoculadas con Bradyrhizobium y coinoculadas con Bradyrhizobium + Azospirillum respectivamente siguiendo el método descrito por otros autores 16.
Anticuerpos contra Azospirillum
Se obtuvieron anticuerpos contra Azospirillum para confirmar que la cepa de Azospirillum inoculada fue la misma que la que se encontró en las raíces de soya. La cepa A. brasilense
8-INICA se cultivó como se indicó anteriormente durante 24 h, en un
volumen conocido de medio BMS. Se concentraron las células y se añadió
formaldehído estéril al sedimento para lograr una concentración final de
5 por 1000 y se dejó durante la noche a 27 ºC. Posteriormente se
centrifugaron a 5000 rpm durante 5 min. El sedimento se lavó con
solución salina tamponada con fosfato estéril pH 7,2 (PBS) y se
suspendió en PBS estéril pH 7 hasta alcanzar 109 cel.mL-1,
medida por densidad óptica a 680 nm. Los sedimentos finales se
suspendieron en cantidades iguales de adyuvante completo de Freund. Se
obtuvo antisuero en conejos blancos por vía de inmunización intravenosa,
una inyección cada ocho días durante cinco semanas. La sangre se
recogió ocho días después de la última inyección. El suero de purga
final de cada conejo se recogió mediante centrifugación de la sangre
coagulada a 2.000 g y se almacenó a -20 ºC. Se obtuvieron sueros de
preinmunización de cada conejo.
Procesamiento de muestreo para microscopíaSolamente las plantas inoculadas con Azospirillum fueron procesadas para microscopía. Para probar la especificidad del antisuero, los cultivos in vitro de Azospirillum se incluyeron primero en agar 17. Las piezas de agar se procesaron como muestras de raíces para embeberse en resina LR-White 18.
Se seleccionaron pequeños trozos de raíces frescas para una etapa de
desarrollo comparable. Las muestras se tomaron en el momento de la
cosecha, se cortaron con una cuchilla de afeitar, se fijaron en
glutaraldehído al 2,5 % (v/v) en 50 mM de cacodilato de Na, pH 7,4 y se
infiltraron al vacío para mejorar la penetración del fijador. La
deshidratación se realizó utilizando una serie de etanol y los nódulos
se infiltraron y finalmente se incluyeron en LR-White Resin (London
Resin Corporation) mediante polimerización por calor a 60 °C durante 24 h
en cápsulas de gelatina 19. Se cortaron
secciones semi-gruesas (1 μm) y ultrafinas (70 nm-espesor) en un
ultramicrotomo Reichert Ultracut S para microscopía óptica y microscopía
electrónica, respectivamente. Las secciones semi-gruesas se tiñeron con
azul de toluidina al 1% (p/v) en borato de sodio acuoso (1 %) para
examen directo utilizando un fotomicroscopio Zeiss Axiophot
Microscopía óptica y electrónica: inmunocitoquímica y silver enhancement
Para la inmunocitoquímica y el silver enhancement,
se colocaron portaobjetos de vidrio con secciones de 1 µm de espesor a
37 ºC, durante la noche para asegurar la adhesión de las secciones. Las
secciones se lavaron a fondo en PBS, pH 7,2, que contenía gelatina pura
al 0,01 %, BSA al 0,1 % y azida sódica al 0,05 %. El bloqueo de los
sitios de unión inespecíficos se logró mediante la incubación de
secciones en la solución anterior que contenía 20 mg de albúmina de
suero bovino (BSA) por mL, durante 20 minutos a temperatura ambiente. La
incubación en anticuerpos primarios (anti-A. Brasilense 8-INICA)
diluidos 1: 500 en el mismo tampón, se llevó a cabo durante 1 h en
horno a 37 ºC. Las secciones se enjuagaron luego en PBS y el exceso de
tampón se eliminó suavemente. La incubación con conjugado de oro
anti-conejo de cabra (GAR 15 nm; BioCell, Cardiff, U.K.) diluido 1:40 en
PBS se realizó durante 1 hora a temperatura ambiente. Las secciones se
enjuagaron luego en PBS y agua destilada. El silver enhancement
se llevó a cabo con el kit IntenSE M (Amersham, Buckinghamshire, U.K.) y
se permitió que progresara mientras se controlaba bajo el microscopio 19.
Las secciones se enjuagaron luego enérgicamente con agua del grifo y
agua destilada, se tiñeron con 0,05 % (w/v) de fucsina básica (Carlo
Erba, Milano, Italia) en etanol acuoso al 5 % (v/v), se enjuagaron y se
dejaron secar. Las secciones fueron montadas y fotografiadas bajo un
fotomicroscopio Zeiss Axiophot. Para microscopía electrónica, se
recogieron secciones (de 70 nm de espesor) en rejillas de níquel e
inmunorotuladas 18. La contracción de las
secciones se obtuvo con acetato de uranilo acuoso al 2 % (5 min) y
citrato de plomo durante 2 min. Después de enjuagar y secar al aire, se
examinaron las secciones utilizando un microscopio electrónico STEM LEO
910 a un voltaje de aceleración de 80 kV.
RESULTADOS Y DISCUSIÓNLa capacidad de A. brasilense para estimular el crecimiento de las plantas ha sido ampliamente demostrada 5,7. Informes anteriores han demostrado que la coinoculación de Rhizobium y Azospirillum mejoró la nodulación y el rendimiento de las plantas leguminosas 2. En nuestros resultados, la inoculación de A. brasilense 8-INICA no produjo cambios en la altura y la biomasa de las partes aéreas de la planta, ni en la actividad nitrogenasa (Tabla 1).
Sin embargo, se observó un aumento del 61,8 % en el peso de la raíz,
con respecto al control, en plantas inoculadas solamente con Azospirillum, mientras que se observó un aumento de solo el 6 % en plantas inoculadas sólo con Bradyrhizobium;
no obstante, la coinoculación produjo un aumento del 11 % en este
parámetro. Se observó un aumento en el peso de los nódulos del 78,9 % en
plantas inoculadas, conjuntamente con plantas inoculadas solamente con Bradyrhizobium.
Dado que el aumento en el peso de los nódulos no se tradujo en un
aumento en la actividad nitrogenasa, este aumento no puede entenderse
como un aumento en el número de bacteroides, sino en el tejido vegetal
del nódulo. Las plantas tratadas sólo con nitrógeno o A. brasilense 8-INICA, respectivamente, no produjeron nódulos. El aumento en el peso de la raíz y los nódulos con la inoculación de Azospirillum fue consistente con otros resultados en Phaseolus vulgaris9) inoculado con Rhizobium tropici y R. etli y la misma especie de Azospirillum. El incremento del crecimiento de la raíz se puede producir mediante una mayor captación de minerales y agua 20, por lo que las inoculaciones de soya con Azospirillum podrían representar una ventaja en el rendimiento del cultivo.
Los tratamientos con Azospirillum y Bradyrhizobium
se regaron con una solución nutritiva libre de nitrógeno y con una
solución que contenía 35 ppm en el tratamiento con nitrógeno. Los datos
son medias seguidas de error estándar de tres repeticiones. Las medias
seguidas por la misma letra dentro de una columna no son
significativamente diferentes. Los datos estadísticos fueron obtenidos
por SPSS.
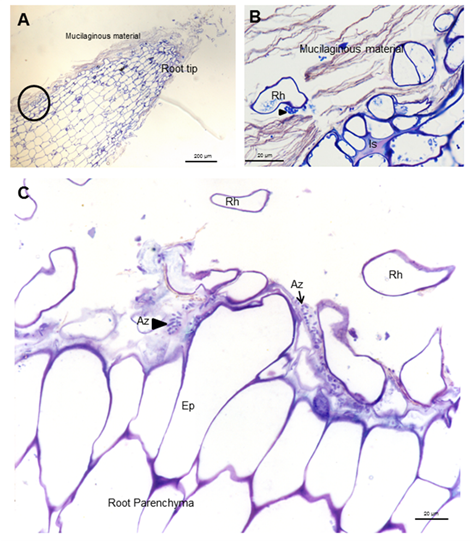
Colonización de raíces de soya por Azospirillum
El establecimiento de poblaciones
bacterianas eficientes en la rizosfera es esencial para mejorar la
colonización de las raíces y la productividad de las plantas 21. La colonización de la raíz de soya se estudió al final del cultivo de plantas, en plantas inoculadas sólo con Azospirillum, utilizando microscopía óptica y electrónica e inmunocitoquímica. A. brasilense
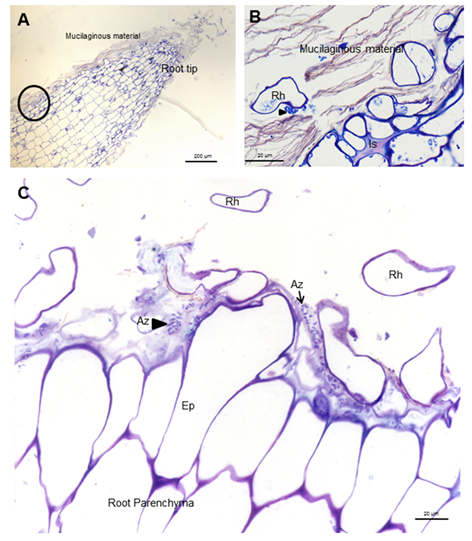
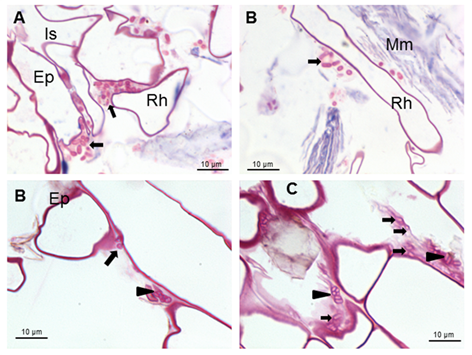
8-INICA colonizó la superficie de la raíz por adhesión al material
mucilaginoso, producido por la planta donde proliferan las bacterias (Figura 1 y Figura 2A y B).
Micrografías ópticas de cortes longitudinales y transversales que muestran colonización de la superficie por A. Brasilense 8-INICA, cinco semanas después de la inoculación, teñidas con azul de toluidina
A, ápice radical B, área enmarcada de A. Azospirillum
aislado (Az y flechas) o formando microcolonias (cabezas de flechas)
dentro del material mucilaginoso Ep (epidermis), Is (intercelular) y Rh
(pelo radical)
Además, se pueden observar los carbohidratos
producidos por las bacterias. Los carbohidratos se detectaron mediante
tinción con fucsina 19. (Figura 1C y Figura 2B y C).
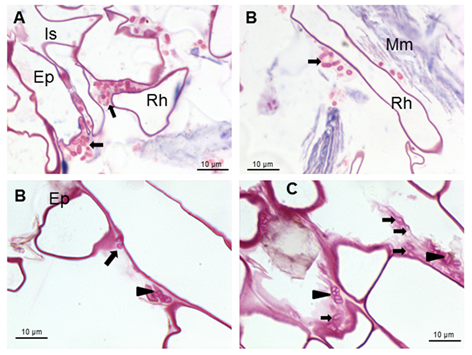
Micrografías ópticas de cortes longitudinales que muestran la colonización de la superficie por A brasilense 8-INICA cinco semanas después de la inoculación, teñidas con fucsina
Las flechas indican las bacterias de Azospirillum
aisladas alrededor de los pelos radicales o formando microcolonias
rodeadas por carbohidratos producidos por las bacterias (cabezas de
flechas) Ep (epidermis), Is (intercelular), Rh (pelo radical) y Mm
(material mucilaginoso)
Estos carbohidratos podrían conferir
protección a la raíz contra condiciones externas y podrían favorecer la
colonización de la bacteria en su hábitat natural 22. Los resultados muestran bacterias muy cerca de los pelos radicales cerca de la punta radical (Figura 1A
y B). Se observan microcolonias en la superficie de la raíz embebidas
en una matriz de polímero de carbohidratos de producción propia que fue
consistente 23, como se muestra en las figuras 2B y C (puntas de flecha) y bajo protección del pelo radical (Figuras 2A
y C). Esto da lugar a la biopelícula, que es un mecanismo que permite a
las bacterias vivir en condiciones extremas o cambiantes y uno de los
más utilizados en la colonización competitiva de raíces por bacterias
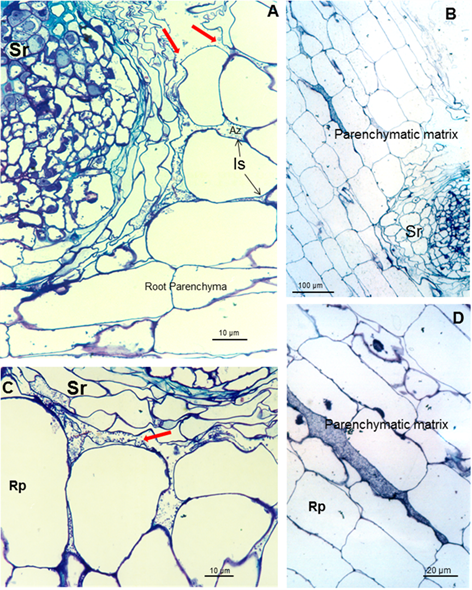
eficientes. Después de la colonización de la raíz superficial, se
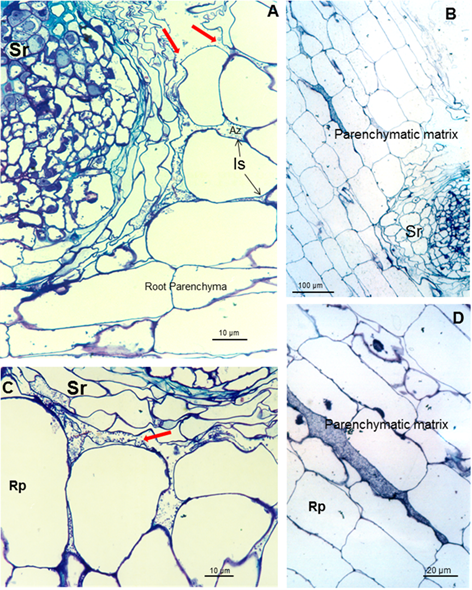
produce la colonización parenquimática intercelular. Azospirillum pudo tomar la ruptura causada por la emergencia de una raíz secundaria (Figuras 3A y B) e ingresar en los espacios intercelulares del parénquima de la raíz de la planta (Figuras 3A
y C) y entre las células epidermis radical, permitiendo la
colonización. La morfología de la raíz cambió como consecuencia de esta
colonización, produciendo una matriz entre dos capas de células del
parénquima de la raíz (Figuras 3B y D).
Micrografías ópticas de cortes longitudinales y transversales de raíces de soya inoculadas con A. brasilense
8-INICA que muestran colonización de las raíces después de cinco
semanas de inoculación (A-C); colonización de las raíces de la soya a
través de los orificios producidos por la aparición de una raíz
secundaria y D los espacios intercelulares de las capas internas de las
células corticales
Las
flechas rojas indican el espacio donde la matriz parenquimática (B)
comienza a formarse entre dos capas de células. Es (espacio
intercelular), Pm (matriz parenquimática), Rp (parénquima de la raíz) y
Sr (raíz secundaria)
Esta matriz parenquimática facilita el
crecimiento bacteriano y las bajas presiones parciales de oxígeno para
la expresión de la nitrogenasa y puede contribuir directamente al
nitrógeno de la planta y asegura el intercambio de nutrientes entre las
bacterias y la planta. Las bacterias del suelo y de la rizosfera pueden
afectar la nutrición mineral de las plantas al cambiar las
características de absorción de la raíz, debido a una modificación de la
morfología de la raíz o la alteración de los mecanismos de absorción,
la tasa de crecimiento relativa o la composición interna de las plantas 24.
El hecho de sobrevivir dentro de la raíz y no producir ninguna lesión
confirma este microorganismo como una bacteria endofítica 25.
Los endófitos pueden ser útiles para proteger a la planta del estrés
ambiental, así como para suministrar nitrógeno y otras sustancias que
promueven el crecimiento 26.
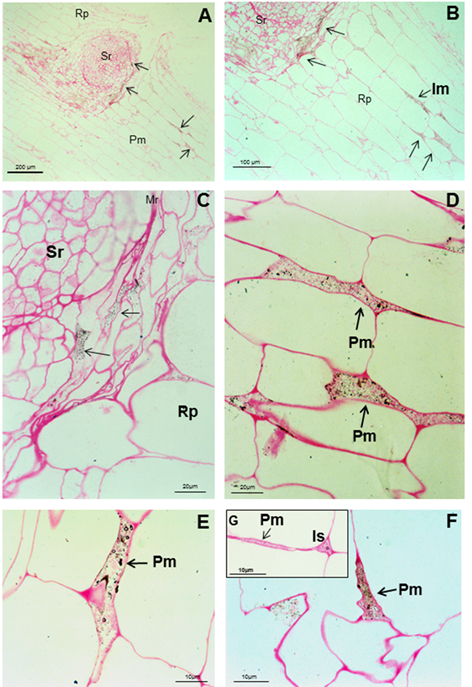
Micrografías
ópticas de cortes longitudinales y transversales a través de la raíz de
soya cinco semanas después de la inoculación de semillas con A. brasilense 8-INICA
Las
bacterias pueden verse como cuerpos negros y cuerpos rodeados por un
círculo negro en la ruptura producida por el surgimiento de una raíz
secundaria (AC), en los espacios intercelulares, el parénquima de las
raíces de soya y dentro de la matriz parenquimática (D, E y F),
señaladas como flechas negras. G es la ampliación del espacio
intercelular y la conexión de la matriz parenquimática. Es (espacio
intercelular), Pm (matriz parenquimática), Rp (parénquima de la raíz) y
Sr (raíz secundaria)
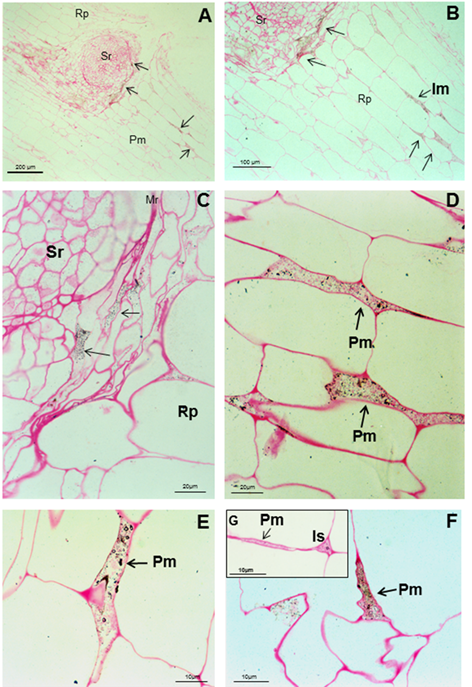
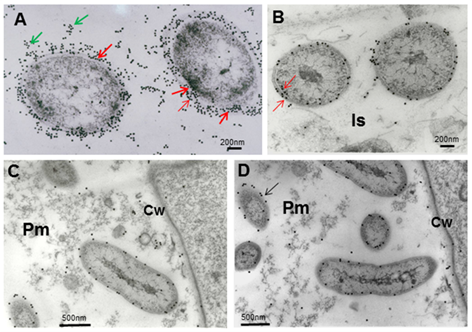
Las reacciones del anti-A brasilense 8-INICA con el microorganismo mostraron, en el microscopio óptico, las bacterias rodeadas de partículas de oro (Figura 4). La inmunolocalización y el silver enhancement demuestran que se logra la colonización por A. brasilense 8-INICA, conociendo que las bacterias están marcadas en la ruptura causada por la aparición de una raíz secundaria (Figura 4A-C), en los espacios intercelulares (Figura 4D) y en la matriz parenquimática producida por la colonización de Azospirillum del parénquima de la raíz (Figura 4D-F). Con el gran aumento en la microscopía óptica (Figura 4G) se puede observar que los espacios intercelulares y la matriz parenquimática están conectados, y Azospirillum
identificado por el anticuerpo puede verse como cuerpos rodeados por un
círculo negro. Estos resultados en experimentos de inoculación en soya
muestran firmemente la colonización por Azospirillum, lo cual es consistente con informes similares sobre arroz 27, tabaco 28, tomate 29 y cebada 30.
En el caso de la caña de azúcar, la controversia de si es solo una
bacteria rizosférica o asociada a la raíz o un endófito, requiere
estudios adicionales que permitan aclarar este aspecto, que podría verse
influido por manifestación de quorum sensing3 y otros factores. La inmunolocalización en portaobjetos ultrafinos de células de Azospirillum, embebidas en agar con el anticuerpo anti-A. brasilense 8-INICA, muestra una enorme afinidad del anticuerpo al antígeno (Figura 5A).
Hay un marcaje intenso de las bacterias con partículas de oro de 15 nm.
El número de partículas de oro es elevado y marcó las diferentes capas
de las envolturas celulares (Figura 5A, flechas).
La
cantidad de partículas de oro disminuye considerablemente cuando el
marcaje se realiza en los espacios intercelulares, como si las bacterias
perdieran algunas de las capas con la colonización del parénquima de la
raíz (Figura 5B), aunque también se puede observar el
marcaje en diferentes capas (flechas). Dentro de la matriz
parenquimática solo una capa aparece marcada (Figura 5C
y D) y no se detectan partículas de oro en el interior de las
bacterias. Se puede observar un marcaje inespecífico en las vesículas de
la matriz parenquimática, probablemente formadas por la degradación de
las membranas bacterianas (Figura 5C).
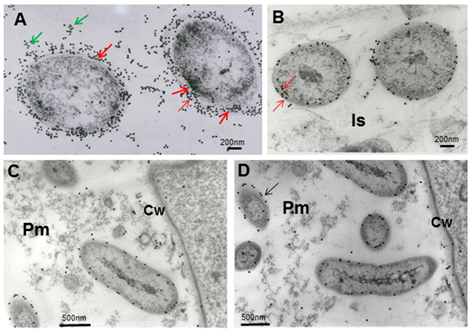
Micrografías electrónicas que muestran la inmunolocalización de los epítopes de A. brasilense
8-INICA que crecen en el medio de cultivo (A) y colonizan los espacios
intercelulares y el parénquima de las raíces de soya (B-D). (A), células
incluidas primero en agar y en resina LR-White
Note el intenso marcaje de las bacterias con partículas de oro de 15 nm (flechas)
B,
note la gran disminución de partículas de oro cuando las bacterias
están colonizando la raíz y llegan a la matriz parenquimática
(B-D), A. brasilense 8-INICA dentro de la matriz parenquimática
Cw (pared celular), Is (intercelular), Pm (matriz parenquimática)
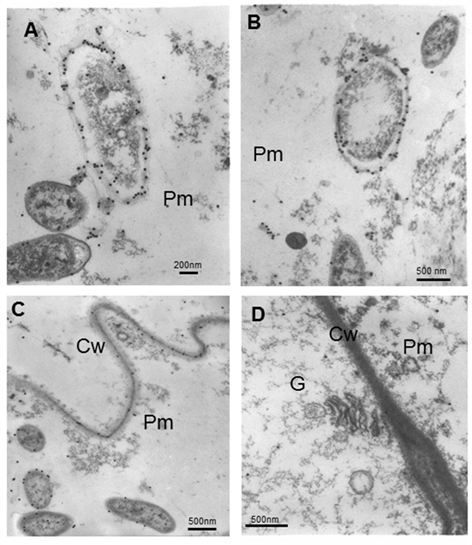
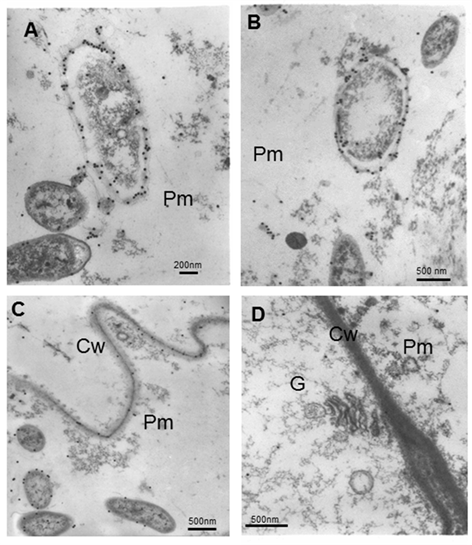
Cuando la bacteria envejece, el citoplasma
se retrae y las partículas de oro permanecen en la capa más externa de
las envolturas de la bacteria (Figura 6A y B). Aunque no es normal, en algunas áreas aparecen partículas de oro en la pared celular (Figura 6C).
Muy pocas partículas de oro aparecen en el citoplasma de las células
adyacentes a la matriz. No hay localización de partículas de oro en
orgánulos envejecidos (Figura 6D).
Micrografías electrónicas que muestran la inmunolocalización de A. brasilense 8-INICA colonizando los espacios intercelulares y el parénquima de las raíces de soya embebidas en la resina LR-White
A y B note que cuando la bacteria envejece el citoplasma se retrae y el marcaje permanece en la capa más externa de la bacteria
C y D Matriz parenquimática y células adyacentes
Cw (pared celular), G (Golgi), Pm (matriz parenquimática)
Azospirillum generalmente se asocia con raíces de pastos como la caña de azúcar, el arroz y el maíz 4,
lo que se traduce en beneficios para las plantas por su contribución a
la nutrición. Las técnicas de microscopía e inmunolocalización
permitieron confirmar en este trabajo que A. brasilense 8-INICA
puede actuar como un endófito en las raíces de soya. Los endófitos
pueden ser útiles para proteger a la planta del estrés ambiental, así
como para suministrar nitrógeno y otras sustancias que promueven el
crecimiento 26. Este trabajo enfatiza que Azospirillum
no sólo es interesante para la inoculación en caña de azúcar, sino
también en la soya y, por lo tanto, funcionaría muy bien en el
intercalamiento de la soya y la caña de azúcar, con la ventaja de no
tener que introducir cepas extrañas en los suelos cubanos.
CONCLUSIONES
brasilense
8-INICA es capaz de colonizar las raíces de la soja, no sólo de forma
superficial, sino también intercelular, formando una matriz
parenquimática que favorece el intercambio entre la bacteria y la
planta, demostrando a A. brasilense 8-INICA como un endófito de
las raíces de soya. Además de sus efectos mejorados sobre el peso de las
raíces y los nódulos en comparación con especies nodulares como B. japonicum
USDA-110, que confirman los informes de otros investigadores, este
resultado de ser un endófito en las raíces de soya es importante para
lograr la sostenibilidad en la agricultura, considerando que las
inoculaciones de campo son amigables con el medio ambiente y una forma
económica y viable de obtener buenas producciones mediante prácticas
agrícolas orgánicas.
Se deben realizar
estudios de campo adicionales en condiciones no controladas con esta
cepa para explorar su potencial como biofertilizante en las prácticas de
cultivo intercalado con esta leguminosa y caña de azúcar. Es importante
destacar que A. brasilense 8-INICA está adaptado a las
condiciones de los suelos cubanos, lo que evita que se introduzcan cepas
extrañas en los ambientes de los suelos cubanos.
AGRADECIMIENTOSEste
trabajo se realizó gracias a los proyectos AECID, A / 8500/07 y A /
019119/08 y el Ministerio de Economía y Competitividad AGL2013-40758-R,
desarrollado entre el ICA-CSIC (Madrid, España) y el INICA (La Habana),
Cuba).
BIBLIOGRAFÍA
1.
Souza R de, Ambrosini A, Passaglia LMP. Plant growth-promoting bacteria
as inoculants in agricultural soils. Genetics and Molecular Biology.
2015;38(4):401-19. doi:10.1590/S1415-475738420150053
2.
Marks BB, Megías M, Nogueira MA, Hungria M. Biotechnological potential
of rhizobial metabolites to enhance the performance of Bradyrhizobium
spp. and Azospirillum brasilense inoculants with soybean and maize. AMB
Express. 2013;3(1):21. doi:10.1186/2191-0855-3-21
3.
Fukami J, Abrantes JLF, del Cerro P, Nogueira MA, Ollero FJ, Megías M,
et al. Revealing strategies of quorum sensing in Azospirillum brasilense
strains Ab-V5 and Ab-V6. Archives of Microbiology. 2018;200(1):47-56.
doi:10.1007/s00203-017-1422-x
4. Vital L, Mendoza HA. Azospirillum: Habitante de las Gramíneas. Revista: La ciencia y el hombre. 2014;XXVII(2):24.
5.
Cassán F, Vanderleyden J, Spaepen S. Physiological and agronomical
aspects of phytohormone production by model plant-growth-promoting
rhizobacteria (PGPR) belonging to the genus Azospirillum. Journal of
Plant Growth Regulation. 2014;33(2):440-59.
doi:10.1007/s00344-013-9362-4
6.
Spaepen S, Bossuyt S, Engelen K, Marchal K, Vanderleyden J.
Phenotypical and molecular responses of Arabidopsis thaliana roots as a
result of inoculation with the auxin-producing bacterium Azospirillum
brasilense. New Phytologist. 2014;201(3):850-61. doi:10.1111/nph.12590
7.
Fukami J, Ollero FJ, Megías M, Hungria M. Phytohormones and induction
of plant-stress tolerance and defense genes by seed and foliar
inoculation with Azospirillum brasilense cells and metabolites promote
maize growth. AMB Express. 2017;7(1):153. doi:10.1186/s13568-017-0453-7
8.
Hungria M, Nogueira MA, Araujo RS. Soybean seed co-inoculation with
Bradyrhizobium spp. and Azospirillum brasilense: a new biotechnological
tool to improve yield and sustainability. American Journal of Plant
Sciences. 2015;06(06):811-7. doi:10.4236/ajps.2015.66087
9.
Burdman S, Kigel J, Okon Y. Effects of Azospirillum brasilense on
nodulation and growth of common bean (Phaseolus vulgaris L.). Soil
Biology and Biochemistry. 1997;29(5-6):923-9.
doi:10.1016/S0038-0717(96)00222-2
10.
Casas M, de Felipe M, Roldós J, Fernández-Pascual M, Guasch L.
Co-inoculaciones de plantas de soja con bacterias de los géneros
Rhizobium, Bradyrhizobium, Sinorhizobium, Azospirillum y Bacillus. In:
Arrese-Igor C, Hernando MR, Tejo PMA, editors. Perspectivas de la
fijación biológica de nitrógeno en el umbral del siglo XXI. España:
Universidad Pública de Navarra; 1998. p. 193-4.
11.
Chimonyo VGP, Modi AT, Mabhaudhi T. Perspective on crop modelling in
the management of intercropping systems. Archives of Agronomy and Soil
Science. 2015;61(11):1511-29. doi:10.1080/03650340.2015.1017816
12.
Pérez J, Casas M. Estudio de la interacción planta-Azospirillum en el
cultivo caña de azúcar (Saccharum sp.). Cultivos Tropicales.
2005;26(4):13-9.
13.
Baldani JI, Reis VM, Videira SS, Boddey LH, Baldani VLD. The art of
isolating nitrogen-fixing bacteria from non-leguminous plants using
N-free semi-solid media: a practical guide for microbiologists. Plant
and Soil. 2014;384(1-2):413-31. doi:10.1007/s11104-014-2186-6
14.
Chibeba AM, Kyei-Boahen S, Guimarães M de F, Nogueira MA, Hungria M.
Feasibility of transference of inoculation-related technologies: A case
study of evaluation of soybean rhizobial strains under the agro-climatic
conditions of Brazil and Mozambique. Agriculture, Ecosystems &
Environment. 2018;261:230-40. doi:10.1016/j.agee.2017.06.037
15.
Vincent JM. A manual for the practical study of root-nodule bacteria
[Internet]. Edimburgo, Escocia: Oxford?: [Published for the]
International Biological Programme [by] Blackwell Scientific; 1970
[cited 2019 Jan 30]. 164 p. Available from: https://trove.nla.gov.au/version/45249216
16.
Fernández-Pascual M, Pozuelo JM, Serra MT, De Felipe MR. Effects of
cyanazine and linuron on chloroplast development, nodule activity and
protein metabolism in Lupinus albus L. Journal of plant physiology.
1988;133(3):288-94.
17.
Lucas MM, Vivo A, Pozuelo JM. Application of immunolabelling techniques
to Bradyrhizobium dual occupation in Lupinus nodules. Journal of Plant
Physiology. 1992;140(1):84-91. doi:10.1016/S0176-1617(11)81062-X
18.
de María N, de Felipe MR, Fernández-Pascual M. Alterations induced by
glyphosate on lupin photosynthetic apparatus and nodule ultrastructure
and some oxygen diffusion related proteins. Plant Physiology and
Biochemistry. 2005;43(10-11):985-96. doi:10.1016/j.plaphy.2005.09.001
19.
de Lorenzo CA, Fernández-Pascual MM, de Felipe MR. Subcellular
localization of glycoprotein epitopes during the development of lupin
root nodules. Protoplasma. 1998;201(1-2):71-84. doi:10.1007/BF01280713
20.
Bashan Y, de-Bashan LE. How the plant growth-promoting bacterium
Azospirillum promotes plant growth-a critical assessment. Advances in
Agronomy. 2010;108:77-136. doi:10.1016/S0065-2113(10)08002-8
21.
Jha PN, Gupta G, Jha P, Mehrotra R. Association of
rhizospheric/endophytic bacteria with plants: a potential gateway to
sustainable agriculture. Greener Journal of Agricultural Sciences.
2013;3(2):73-84. doi:10.15580/GJAS.2013.2.010313354
22.
Zivkovic M, Miljkovic M, Ruas-Madiedo P, Strahinic I, Tolinacki M,
Golic N, et al. Exopolysaccharide production and ropy phenotype are
determined by two gene clusters in putative probiotic strain
Lactobacillus paraplantarum BGCG11. Applied and Environmental
Microbiology. 2015;81(4):1387-96. doi:10.1128/AEM.03028-14
23.
Flemming H-C, Wingender J, Szewzyk U, Steinberg P, Rice SA, Kjelleberg
S. Biofilms: an emergent form of bacterial life. Nature Reviews
Microbiology. 2016;14(9):563-75. doi:10.1038/nrmicro.2016.94
24.
Xiaohui FAN, Zhang S, Xiaodan MO, Yuncong LI, Yuqing FU, Zhiguang LIU.
Effects of plant growth-promoting rhizobacteria and N source on plant
growth and N and P uptake by tomato grown on calcareous soils.
Pedosphere. 2017;27(6):1027-36. doi:10.1016/s1002-0160(17)60379-5
25.
Reinhold-Hurek B, Hurek T. Life in grasses: diazotrophic endophytes.
Trends in Microbiology. 1998;6(4):139-44.
doi:10.1016/S0966-842X(98)01229-3
26.
Waqas M, Kim Y-H, Khan AL, Shahzad R, Asaf S, Hamayun M, et al.
Additive effects due to biochar and endophyte application enable soybean
to enhance nutrient uptake and modulate nutritional parameters. Journal
of Zhejiang University-SCIENCE B. 2017;18(2):109-24.
doi:10.1631/jzus.B1500262
27.
Rariz Mollo G, Ferrando L, Fernandez Scavino A. Aislamiento de
bacterias endófitas fijadoras de nitrógeno en plantas de arroz
cultivadas en diferentes suelos. In: VII Congreso de Medio Ambiente. La
Plata, Argentina: Asociación de Universidades Grupo Montevideo; 2012. p.
20. Available from: http://hdl.handle.net/10915/26387
28.
Chi F, Shen S-H, Chen S-F, Jing Y-X. Migration of Azospirillum
brasilense Yu62 from root to stem and leaves inside rice and tobacco
plants. ACTA BOTANICA SINICA. 2004;46(9):1065-70.
29.
Fujita M, Kusajima M, Okumura Y, Nakajima M, Minamisawa K, Nakashita H.
Effects of colonization of a bacterial endophyte, Azospirillum sp.
B510, on disease resistance in tomato. Bioscience, Biotechnology, and
Biochemistry. 2017;81(8):1657-62. doi:10.1080/09168451.2017.1329621
30.
Zawoznik M, Vázquez S, Díaz Herrera SM, Groppa MD. Search for
endophytic diazotrophs in barley seeds. Brazilian Journal of
Microbiology. 2014;45(2):621-5. doi:10.1590/S1517-83822014000200033
[/refs]
Traducir DocumentoOriginal ArticleResponse of soybean (Glycine max (L) Merr) to inoculation with Azospirillum and Bradyrhizobium
Mario Alberto-Casas [1] [*]
Susana Fajardo-Molina [2]
Cesar Morcillo-Blanco [2]
Mercedes Fernández-Pascual [2]
[1] Instituto de Investigaciones de la Caña de Azúcar (INICA), carretera CUJAE Km 1½, Rancho Boyeros, CP 19390, La Habana, Cuba
[2] Instituto
de Ciencias Agrarias (ICA-CSIC), Consejo Superior de Investigaciones
Científicas (CSIC), Serrano 115, dpdo., CP 28006 Madrid, España
[*] Author for correspondence. marioalbertocasas@gmail.com
ABSTRACTAzospirillum brasilense
is a nitrogen-fixing plant growth promoting rhizobacterium with
potential as biofertiliser for leguminous and non-leguminous plants.
Agriculturally important crops, especially sugar cane, have been often
inoculated with A. brasilense producing increases in growth parameters and yield in different soils and climatic regions. Sugar cane inoculated with A. brasilense
has been grown in intercropping with legumes like beans and soybean. In
field experiments of intercropping of sugarcane inoculated with A. brasilense
and soybean carried out in Cuban soils, an increase in most of the
growth parameters of sugarcane have been observed, but it is not known
the effects produced on the other intercropped plant. This work analyzes
the alterations in plant and nodule development, nitrogenase activity
and colonization of roots by Azospirillum, in soybean inoculated with A. brasilense 8-INICA and Bradyrhizobium japonicum USDA-110. A. brasilense
inoculation did not produced changes in the height and biomass of
aerial parts of the plant or in nitrogenase activity in nodules. However
increases in root and nodule biomass were detected with its
inoculation. A. brasilense colonized root surface by adhesion to
mucilaginous material where bacteria proliferate and are able to form
microcolonies inside. The break caused by the emergence of a secondary
root allowed the bacterium to enter in the intercellular spaces of plant
root parenchyma and between epidermal root cells, allowing soybean root
colonization. These results suggested that A. brasilense 8-INICA
can live as an endophyte in soybean roots and could be a suitable
candidate like inoculant of leguminous with agricultural purposes.
INTRODUCTIONThe
importance of increasing crop yields in subsistence farming systems
characterized by a minimal use of mineral fertilizers goes through
improve beneficial microorganisms-root-soil interactions leading to
higher crop yields 1.The effect on legumes
of co-inoculation with nitrogen-fixing symbiotic bacteria and
non-symbiotic plant growth promoting genera (PGPRs) is gaining
increasing interest within the current biological nitrogen fixation and
has been proposed like a new biotechnological tool to improve yield and
sustainability 2.
A. brasilense
is a nitrogen-fixing plant growth promoting rhizobacterium (PGPR) with a
substantial potential as biofertilizer for leguminous and
non-leguminous plants. Agriculturally important crops, especially sugar
cane, have been often inoculated with A. brasilense producing increase in growth parameters and yield in different soils and climatic regions 3.
Different mechanisms of action have been proposed to explain the
enhancement of plant growth, like proliferation of the root system 4.The stimulation of growth is usually due to the production of phytohormones such as auxins, cytokinins, gibberellins 5,6. Furthermore induction of plant-stress tolerance and defense genes has been described 7.
The combined application of bacteria of the genus Rhizobium or Bradyrhizobium with Azospirillum, produced a positive effect on legumes 8.
The positive effect results in early nodulation, increase in nodule
numbers, nitrogenase activity and root respiration, as well as an
overall improvement in the uptake of water and nutrients by the roots. Azospirillum
PGPR characteristics may be the reason for its effect on legume
co-inoculations, which would be related to the induction of a greater
number of infective root hairs, differentiated from epidermal cells and
an increase in the secretion of flavonoids inducing nod genes 9.
Intercropping
is a sustainable method for crop production used to maximize
utilization of available resources and could improve biodiversity of
soils. In tropical soils it has been proven that the intercropping of
grasses with legumes, represents a group of advantages among which we
can point out the contribution of nitrogen to the soil and the obtaining
of additional productions of fiber, fat and food 10. Furthermore, intercropping improves resilience, food security 11 and nutrition.
In field experiments of intercropping of sugarcane inoculated with A. brasilense and not-inoculated soybean, carried out in Cuban soils 10, increases in most of the growth parameters of sugarcane have been observed, but it is not known the effects produced by Azospirillum inoculation on the other intercropped plant. The aim of this work was to evaluate, under controlled conditions, the effect of A. brasilense 8-INICA and B. japonicum
USDA-110 by separated and co-inoculation of the two microorganisms in
plant height, shoot and root fresh weight, nodule dry weight and
nitrogenase activity in nodules of soybean roots (Glycine max (L) Merr), emphasizing in soybean root colonization by Azospirillum.
MATERIALS AND METHODSStrainsA. brasilense 8-INICA strain isolated from sugarcane cv. Ja 60-5 rhizosphere in Ciego de Ávila province, Cuba 12 cultured in NFb medium at 28 ºC, 100 rpm and maintained in BMS broth 13 containing 20 % (v/v) glycerol at -80 ºC. B. japonicum USDA-110 14
donned by Centro de Investigación y Formación Agraria Las
Torres-Tomejil (Sevilla, Spain), grown and maintained in Vincent medium 15.
Plant growth and nitrogenase activitySoybean (Glycine max cv. Williams) seeds were surface sterilized in 0.1 % HgCl2
for 5 min and then washed several times with sterile distilled water.
Seeds were sown in 1 L autoclaved Leonard jars filled with sterile
vermiculite and inoculated with 1 mL of A. brasilense 8-INICA or B. japonicum USDA-110 suspension containing 108 colony forming units (CFU mL-1).
Treatments were: Nitrogen (control treatment) non-inoculated plants and
watered with a solution containing 35 ppm of nitrogen in form of
potassium nitrate, plants inoculated only with A. brasilense 8-INICA, plants inoculated only with B. japonicum
USDA-110 and plants inoculated with the two microorganisms. The
inoculations treatments were watered with a free nitrogen nutritive
solution. Nutrive solutions were replaced three times per week. The
conditions of the growth chamber were: a 16-h-light/8-h-dark
photoperiod, 25 ºC day/15 ºC night temperature, 58 % relative humidity
and an irradiance level of 200 μm m-2 s-1. Three
replicates were used for inoculated and non-inoculated plants. After
five weeks plants were harvested for plant growth parameter
determinations and microscopy purposes. It was determined plant height,
shoot and root fresh weight, nodule dry weight and nitrogenase activity
in nodules. Nitrogenase activity was measured by the acetylene reduction
assay (ARA) on nodulated roots from plants inoculated with Bradyrhizobium and co-inoculated with Bradyrhizobium + Azospirillum, following the method described by other authors 16.
Processing of sampling for microscopyAntibodies against Azospirillum were obtained in order to confirm that the strain of Azospirillum inoculated was the same that those that was found in soy roots. A. brasilense
8-INICA strain was cultivated as indicated above for 24 h, in a known
volume of BMS medium. Cells were harvested and sterile formaldehyde was
added to the pellet to achieve a final concentration of 5 per 1000 and
left overnight at 27 ºC. Cells were centrifuged at 5000 rpm for 5 min.
The pellet was washed with sterile phosphate buffer saline pH 7.2 (PBS)
and suspended in sterile PBS pH 7 until reaching109 cell mL-1,
measured by optical density at 680 nm. The final pellets were suspended
in equal quantities of Freund's complete adjuvant. Antiserum was
obtained in white rabbits by intravenous immunization route, one
injection every eight days for five weeks. Blood was collected eight
days after the last injection. The final bleed-out serum from each
rabbit was collected by centrifuging clotted blood at 2.000 g and stored
at -20 ºC. Preimmunization sera were obtained from each rabbit.
Processing of sampling for microscopyOnly plants inoculated with Azospirillum were processed for microscopy. In order to prove the specificity of the antiserum, Azospirillumin in vitro cultures were embedded first in agar 17.The agar pieces were processed as root samples to be embedded in LR-White resin 18.
Small pieces of fresh roots were selected for a comparable stage of
development. Samples were taken at harvest time, cut with a razor blade,
fixed in 2.5 % (v/v) glutaraldehyde in 50 mM Na-cacodylate, pH 7.4 and
vacuum-infiltrated to enhance penetration of the fixative. Dehydration
was performed using an ethanol series and nodules pieces were
infiltrated and finally embedded in LR-White Resin (London Resin
Corporation) by heat polymerization at 60 °C for 24 h in gelatin
capsules 19. Semi-thick (1 μm) and
ultrathin (70 nm-thick) sections were cut in a Reichert Ultracut S
ultramicrotome for light microscopy, and electron microscopy,
respectively. The semi-thick sections were stained with 1 % (w/v)
toluidine blue in aqueous sodium borate (1 %) for direct examination
using a Zeiss Axiophot photomicroscope.
Light and electron microscopy: immunocytochemistry and silver enhancementFor
immunocytochemistry and silver enhancement, glass slides with 1 µm
thick sections were placed at 37 ºC, overnight to ensure adhesion of
sections. Sections were thoroughly washed in PBS, pH 7.2, containing
0.01 % pure gelatin, 0.1 % BSA, and 0.05 % sodium azide. Blocking of
unspecific binding sites was achieved by incubation of sections in the
above solution containing 20 mg of Bovine Serum Albumine (BSA) per mL,
for 20 min at room temperature. Incubation in primary antibodies (anti-A. brasilense
8-INICA) diluted 1:500 in the same buffer, was carried out for 1 h in
oven at 37 ºC. Sections were then rinsed in PBS and the excess of buffer
gently removed. Incubation with goat anti-rabbit gold conjugate (GAR 15
nm; BioCell, Cardiff, U.K.) diluted 1:40 in PBS was performed for 1 h
at room temperature. Sections were then rinsed in PBS and distilled
water. Silver enhancement was carried out with IntenSE M Silver
Enhancement Kit (Amersham, Buckinghamshire, U.K.) and allowed to
progress while monitored under the microscope 19.
Sections were then energetically rinsed in tap and distilled water,
counterstained with 0.05 % (w/v) basic fuchsine (Carlo Erba, Milano,
Italy) in 5 % (v/v) aqueous ethanol, rinsed and let to dry. Sections
were then mounted and photographed under a Zeiss Axiophot
photomicroscope. For electron microscopy, sections (70 nm thick) were
collected on nickel grids and immunolabelled 18.
Counterstaining of sections was obtained with 2 % aqueous uranyl
acetate (5 min) and lead citrate for 2 min. After rinsing and
air-drying, sections were examined using a STEM LEO 910 electron
microscope at an accelerating voltage of 80 kV.
RESULTS AND DISCUSSIONThe ability of A. brasilense to stimulate plant growth has been extensively demonstrated 5,7. Previous reports have shown that co-inoculation of Rhizobium and Azospirillum enhanced the nodulation and yield of leguminous plants 2. In our results, A. brasilense
8-INICA inoculation did not produced changes in the height and biomass
of aerial parts of the plant nor in nitrogenase activity (Table 1). However an increase of 61.8 % in root weight with respect to control was observed in plants inoculated only with Azospirillum, while an increase of only 6 % was observed in plants inoculated only with Bradyrhizobium.
Nevertheless co-inoculation produced an increase of 11 % in this
parameter. An increase in nodule weight of 78.9 % was observed in
co-inoculated plants with respect to plants inoculated only with Bradyrhizobium.
Since the increase in the weight of the nodules did not translate into
an increase in nitrogenase activity, this increase cannot be understood
as an increase in the number of bacteroids, but rather in the vegetable
tissue of the nodule. Plants treated only with nitrogen or A. brasilense 8-INICA respectively did not produce nodules. The increase in root and nodule weight with Azospirillum inoculation was consistent with others results in Phaseolus vulgaris9 inoculated with Rhizobium tropici and R. etli and the same species of Azospirillum. Improvement of root growth can be produced by enhanced uptake of minerals and water 20, thus, Azospirillum inoculations of soybean could represent an advantage in crop yield.
Azospirillum and Bradyrhizobium
treatments were watered with a nitrogen free nutritive solution and
with a solution containing 35 ppm in the nitrogen treatment. Data are
means followed by standard error of three repetitions. Means followed by
the same letter within a column are not significantly different.
Statistical data were obtained by SPSS.
Soybean roots colonization by Azospirillum
The establishment of efficient bacterial
populations in the rhizosphere is essential to improve root colonization
and plant productivity 21. Soybean root colonization was studied at the end of plant culture in plants inoculated only with Azospirillum, using light and electron microscopy and immunocytochemistry. A. brasilense8-INICA colonized root surface by adhesion to mucilaginous material produced by the plant where bacteria proliferate (Figure 1 and Figure 2A and B).
Light micrographs of longitudinal and transverse sections showing A. Brasilense 8-INICA, surface colonization five weeks after inoculation, stained with toluidine blue
A, root apice B, framed area of A. Azospirillum
isolated (Az and arrows) or forming microcolonies (arrows heads) inside
the mucilaginous material Ep (Epidermis), Is (intercellular) and Rh
(root hair)
Furthermore, carbohydrates produced by the bacteria can be observed. Carbohydrates were detected by fuchsine staining 19. (Figure 1C and Figure 2B and C).
Light micrographs of longitudinal sections showing Azospirillum brasilense 8-INICA surface colonization five weeks after inoculation, stained with fuchsine
Arrows indicate Azospirillum
bacteria isolated around the root hairs or forming microcolonies
surrounded by carbohydrates produced by the bacteria (arrows heads) Ep
(Epidermis), Is (Intercellular), Rh (Root hair) and Mm (Mucilaginous
material)
These carbohydrates could be able to
confer protection to the root against external conditions and may favor
colonization of the bacterium in its natural habitat 22. Results show bacteria very close to root hairs near the radicular tip (Figure 1A
and B). Microcolonies are observed on the root surface embedded in a
self-produced carbohydrate polymer matrix which was consistent 23, as shown in figures 2B and C (arrowheads) and under protection of the root hair (Figures 2A
and C). This gives rise to biofilm, which is a mechanism that allows
bacteria to live in extreme or changing conditions and one of the most
widespread used in competitive root colonization of efficient bacteria.
After surface root colonization, the intercellular parenchymatic
colonization is produced. Azospirillum was able to take the break caused by the emergence of asecondary root (Figures 3A and B) and enter in the intercellular spaces of plant root parenchyma (Figures 3A
and C) and between epidermal root cells allowing the colonization. Root
morphology changed as a consequence of this colonization, producing a
matrix between two layers of parenchyma root cells (Figures 3B and D).
Light micrographs of longitudinal and transverse sections of soybean roots inoculated with A. brasilense
8-INICA showing root colonization after five weeks of inoculation
(A-C); colonization of soybean roots through the gaps produced by the
emergence of a secondary root and D the intercellular spaces of inner
layers of cortical cells
Red
arrows indicate the gap where the parenchymatic matrix (B) starts to be
formed between two layers of cells. Is (Intercellular space), Pm
(Parenchymatic matrix), Rp (root parenchyma) and Sr (Secondary root)
This parenchymatic matrix facilitates
bacterial growth and the low oxygen partial pressures for the expression
of nitrogenase and can directly contribute to nitrogen to the plant and
the exchange of nutrients between the bacteria and the plant is
assured. Soil and rhizosphere bacteria can affect the mineral nutrition
of plants by changing root-uptake characteristics, due to a modification
of root morphology or alteration of uptake mechanisms, relative growth
rate or internal composition of plants
24).
The fact to survive inside the root and not producing any injuries confirm this microorganism as an endophytic bacterium 25.
Endophytes can be helpful in protecting the plant from environmental
stress as well as in supplying the plant with nitrogen and other growth
promoting substances 26.
Light micrographs of longitudinal and transverse sections through soybean root five weeks after seed inoculation with A. brasilense 8-INICA
The
bacteria can be seen as black bodies and bodies surrounded by a black
circle in the rupture produced by the emergence of a secondary root
(CA), in the intercellular spaces, the parenchyma of the roots of
soybean and within the parenchyma matrix (D, E and F), marked as black
arrows. G is the expansion of the intercellular space and the connection
of the parenchymal matrix. It is (intercellular space), Pm (parenchymal
matrix), Rp (parenchyma of the root) and Sr (secondary root)
Anti-A. brasilense 8-INICA reactions with the microorganism, showed, at light microscopy, the bacteria surrounded by gold particles (Figure 4). Immunolocalization and silver enhancement demonstrates that colonization by A. brasilense 8-INICA is achieved, knowing that the bacteria are labelled in the break caused by the emergence of a secondary root (Figure 4A-C), in the intercellular spaces (Figure 4D) and in the parenchyma matrix produced by Azospirillum colonization of plant root parenchyma (Figure 4D-F). With the high magnification at light microscopy (Figure 4G) it can be observed that the intercellular spaces and the parenchymatic matrix are connected, and Azospirillum
identified by the antibody can be seen as bodies surrounded by a black
circle. These results in inoculation experiments in soybean firmly show
colonization by Azospirillum which is consistent with similar reports on rice 27, tobacco 28, tomato 29 and barley 30.
In the case of sugarcane, the controversy of whether it is only a
rhizospheric or a root associated bacterium or an endophyte requires
further studies leading to clarify this aspect which could be influenced
by quorum sensing3 and other factors. Immunolocalization in ultrathin slides of Azospirillum cells embedded in agar with the antibody anti-A. brasilense 8-INICA shows an enormous affinity of the antibody to the antigen (Figure 5A).
There is intense labeling of the bacteria with 15 nm gold particles.
The number of gold particles is elevated and marked the different layers
of the cellular envelopes (Figure 5A, arrows).
The
number of gold particles decreases considerably when the marking is
done in the intercellular spaces, as if the bacteria would lose some of
the layers with the colonization of the root parenchyma (Figure 5B),
although still labeling in different layers can also be observed
(arrows). Inside the parenchymatic matrix only one layer is labeled (Figure 5C
and D) and no gold particles are detected inside the bacteria.
Unspecific labeling can be observed in vesicles of the parenchymatic
matrix, probably formed by bacterium membranes degradation (Figure 5C).
Electron micrographs showing immunolocalization of A. brasilense
8-INICA epitopes growing in culture medium (A) and colonizing the
intercellular spaces and the parenchyma of soybean roots (B-D)
(A), cells embedded first in agar and in LR-White resin
Note the intense labeling of the bacteria with 15 nm gold particles (arrows)
B, note the big decrease of gold particles when the bacteria are colonizing the root and arrive to parenchymatic matrix
(B-D), A. brasilense 8-INICA inside the parenchymatic matrix
Cw (Cell wall), Is (Intercellular), Pm (Parenchymatic matrix)
When the bacterium ages, the cytoplasm is
retracted and the gold particle remains on the outermost layer of the
bacterium envelopes (Figure 6A and B). Although not normal, in some areas appear gold particles on the cell wall (Figure 6C).
Very few gold particles appear in the cytoplasm of adjacent cells to
the matrix. There is no localization of gold particles in aged
organelles (Figure 6D).
Electron micrographs showing immunolocalization of A. brasilense 8-INICA, colonizing the intercellular spaces and the parenchyma of soybean roots embedded in LR-White resin
A and B note that when the bacteria age, the cytoplasm retracts and the label remains on the outermost layer of the bacteria
C and D Parenchymatic matrix and adjacent cells. Cw (Cell wall), G (Golgi), Pm (Parenchymatic matrix)
Azospirillum is usually associated with roots of grasses such as sugar cane, rice and maize 4,
translating benefits to the plants for its contribution to nutrition.
Microscopy techniques and immunolocalization allowed to confirm in this
work that A. brasilense 8-INICA can act as an endophyte in
soybean roots. Endophytes can be helpful in protecting the plant from
environmental stress as well as in supplying the plant with nitrogen and
other growth promoting substances 26. This work emphasizes that Azospirillum
is not only interesting for sugarcane inoculation, but also for soybean
and therefore would work very well in intercropping of soybean and
sugarcane, with the advantage of not having to introduce foreign strains
in Cuban soils.
CONCLUSIONS
A. brasilense
8-INICA is able to colonize soybean roots, not only superficially but
also intercellularly forming a parenchymatic matrix which favors the
exchange between the bacterium and the plant, making A. brasilense
8-INICA an endophyte of soybean roots. Besides its enhanced effects on
root and nodule weight in comparison with nodulating species like B. japonicum
USDA-110, which confirm reports of other researchers, this result of
being an endophyte in soybean roots is important in order to accomplish
sustainability in agriculture, considering that field inoculations are
environmental friendly and an economical feasible way to obtain good
productions by means of organic agricultural practices.
Further
field studies under non-controlled conditions must be carried out with
this strain in order to explore its potential as a biofertilizer in
intercropping practices with this leguminous and sugarcane. Is important
to emphasize that A. brasilense 8-INICA is fit to Cuban soils conditions which avoids foreign strains to be introduced in Cuban soil environments.