Translate PaperArtículo originalEfecto del extracto acuoso foliar de moringa en la fase inicial de aclimatización de piña
Lianny Pérez-Gómez [1] [*]
Iris Capote-Betancourt [1]
Lelurlys Nápoles-Borrero [1]
Claudia Linares-Rivero [1]
Maritza Escalona-Morgado [1]
Romelio Rodríguez-Sánchez [1]
Aurora Terylene Pérez-Martínez [1]
[*] Autor para correspondencia. lianny@bioplantas.cu
RESUMENLas hojas de Moringa oleifera
Lam. poseen varios constituyentes químicos como: aminoácidos, iones
minerales, ascorbato, fitohormonas y metabolitos secundarios. Esto hace
que sus extractos se utilicen para potenciar el crecimiento de algunas
plantas. Además, se le adjudica actividad antimicrobiana frente a
patógenos de interés agrícola. El presente trabajo tuvo como objetivo
evaluar el efecto del extracto acuoso obtenido de hojas de moringa en
los cambios morfológicos de las plantas de Ananas comosus var.
comosus ‘MD-2’ en la etapa inicial de la aclimatización. Se evaluó el
efecto de la concentración (diluciones de 1:4 y 1:8) y el tiempo de
inmersión (0, 24, 48 y 72 horas) en el extracto acuoso de moringa previo
a la aclimatización de plantas de piña. Además, se comparó el extracto
acuoso de moringa y el Previcur® Energy LS 84 en la
aclimatización de plantas de piña. Con la inmersión de las plantas de
piña por 24 y 48 horas en el extracto acuoso diluido 1:4 y por 72 horas
en extracto acuoso diluido 1:8 se logró el 100 % de supervivencia. Los
indicadores morfológicos fueron mayores con la inmersión de plantas de
piña por 72 horas en extracto acuoso diluido 1:8, luego de 42 días en
aclimatización. No se apreciaron diferencias significativas en los
indicadores morfológicos de las plantas tratadas solo con Previcur®Energy LS 84 y con extracto acuoso diluido 1:8. En estos tratamientos no se observaron síntomas visibles de enfermedades.
INTRODUCCIÓNEn los últimos años, la Moringa oleifera
Lam. se ha utilizado ampliamente en la alimentación humana y animal, en
la medicina tradicional, en la producción de biodiesel y en la
industria farmacéutica y cosmética 1-3.
Además, a sus extractos se les adjudican actividad bioestimulante
debido a que son ricos en aminoácidos, iones minerales, ascorbato y
fitohormonas 4,5.
Esto hace que favorezca el crecimiento de algunas plantas, lo que
permite su uso en distintas ramas de la agricultura. Sin embargo, en la
mayoría de los estudios, los extractos de hojas de moringa se han
utilizado para estimular la germinación de las semillas de leguminosas y
cereales, así como evaluar su efecto en el crecimiento y desarrollo de
las plantas 6,7.
La presencia en los extractos de moringa de fitoquímicos como
cumarinas, flavonoides, terpenoides, carotenoides, taninos y compuestos
fenólicos le confiere actividad antimicrobiana frente a patógenos de
interés agrícola 8-10.
La piña (Ananas comosus var. comosus)
es la tercera fruta de mayor producción mundial. Posee un agradable
sabor y aroma, así como vitaminas C, B1, B6, ácido fólico y minerales
como el K
+ (11)
. En el año 2016, su producción mundial ascendió a 25 809 038 toneladas y en Cuba a 48 501 toneladas 12.
Para los países productores de piña y en particular para Cuba, la
deficiencia de material de propagación es un problema que se presenta
cuando se desea fomentar nuevas áreas o introducir una nueva variedad.
El
híbrido ‘MD-2’ posee características de gran importancia económica,
como son los altos rendimientos y la calidad de la fruta. Es uno de los
cultivares con mayores volúmenes de importación como fruta fresca en los
mercados de Estados Unidos y la Unión Europea (13). Sin embargo, las
plantas cultivadas en el campo promedian apenas dos propágulos por ciclo
productivo. Esto hace necesario establecer esquemas de producción de
semillas a través de la biotecnología y evaluar su introducción en las
condiciones de Cuba y, en específico, del territorio avileño.
El
desarrollo de las técnicas de micropropagación ha tenido resultados
altamente ventajosos en la propagación rápida y con calidad, de diversas
especies de plantas económicamente importantes 14.
En este entorno, el Centro de Bioplantas, desarrolló un protocolo de
micropropagación basado en el uso del medio líquido y la tecnología de
inmersión temporal, unido a la implementación de un sistema
semiautomatizado 15, que posibilita
reducir el tiempo necesario para generar cantidades suficientes de
vitroplantas destinadas a la creación de bancos de semillas básicas que
permitan el fomento de plantaciones piñeras con semilla de alta calidad.
Una
de las etapas determinantes en el protocolo general de propagación es
la aclimatización, debido a que las plantas experimentan cambios
fisiológicos que pueden influir en las etapas siguientes. La piña posee
un lento crecimiento, lo que dilata la duración de esta fase. Además,
las plantas de piña durante la aclimatización pueden verse afectadas por
oomicetes y hongos fitopatógenos, fundamentalmente, de los géneros Phytophtora, Fusarium y Rhizoctonia, produciéndose pérdidas importantes 16.
Este trabajo tuvo como objetivo evaluar el efecto del extracto acuoso obtenido a partir de hojas de Moringa oleifera Lam. en los cambios morfológicos de las plantas de piña ‘MD-2’ en la etapa inicial de la aclimatización.
MATERIALES Y MÉTODOSMaterial vegetalEl material vegetal de piña (Ananas comosus
var. comosus) ‘MD-2’ lo suministró el Laboratorio de Escalado y
Transferencia Tecnológica del Centro de Bioplantas. Se utilizaron
plantas que provenían de la fase de enraizamiento in vitro (30 días) y se encontraban en un medio de cultivo que contenía: sales MS 17, 100 mg L-1 de mioinositol, sacarosa al 30 g L-1, 0,1 mg L-1 de tiamina-HCl y 2,69 µmol L-1 de ácido naftalen acético (ANA).
Obtención y caracterización del extracto acuoso de hojas de moringaPara obtener el extracto acuoso se utilizaron las hojas de Moringa oleifera
Lam. cv. Supergenius provenientes de plantas adultas de tres años,
crecidas en la Estación Experimental “Juan Tomás Roig”, Centro de
Bioplantas, que poseían los componentes fitoquímicos que se muestran en
la Tabla 1.
Para la obtención del extracto acuoso se
molieron 400 g de masa fresca de hojas de moringa con nitrógeno líquido
en batidora comercial. La proporción de material vegetal y agua fue de
1:2.5 (m:v). La extracción se realizó durante una hora con agitación y
posteriormente se filtró con gasa para eliminar el material vegetal. A
continuación, se centrifugó la muestra durante 20 minutos a 15 000 x g y
se colectó el sobrenadante. Al extracto acuoso se le determinó la
concentración de proteínas 18, la concentración de carbohidratos 19 y la concentración de compuestos fenólicos solubles 20 (Tabla 2).
Efecto de la concentración y el tiempo de inmersión en el extracto acuoso de moringa en la aclimatización de plantas de piñaSe seleccionaron plantas homogéneas enraizadas in vitro
para su aclimatización, las cuales poseían entre 0,8-1,62 g de masa
fresca, 8-10 cm de longitud, 4-6 hojas y 3-4 raíces, como establece el
instructivo técnico para la propagación de la piña del Centro de
Bioplantas 21. Se prepararon dos
disoluciones del extracto acuoso de moringa: extracto diluido cuatro
veces (1:4) y extracto diluido ocho veces (1:8). Las raíces de las
plantas se sumergieron durante: 0, 24, 48 y 72 horas en las
disoluciones. Se utilizaron 7,5 mL de las diluciones del extracto
acuoso/planta.
Las mismas se colocaron el tiempo
que duró la inmersión en cámaras de cultivo (KOXKA; mod. EC -1200F) con
condiciones ambientales controladas. La temperatura (25±1 °C), flujo de
fotones fotosintéticos (FFF=80 µmol m-2s-1) y
humedad relativa (HR=70 %) se fijaron durante todo el experimento para
favorecer el desarrollo del cultivo, el fotoperiodo fue de 16 horas luz y
ocho horas de oscuridad.
Las plantas fueron sembradas en envases plásticos con un volumen de 222,59 cm3
con mezcla del sustrato tamizado de suelo Ferralítico Rojo y cachaza
(derivado de la caña de azúcar) a una proporción de 1:1 (v/v). Las
mismas fueron aclimatizadas en una casa de cultivo bajo condiciones de
80±3 % de humedad relativa, 30±2 °C de temperatura, luz natural con
flujo de fotones fotosintéticos de 400±25 µmol m-2s-1 y condiciones atmosféricas de concentración de CO2
y fotoperiodo natural. Estas se asperjaron cada 10 días con una mezcla
de fertilizante foliar que contenía 16,0 g de N-P-K cristalino y 1,0 g
de Multimicro Combi (Haifa Chemicals Ltd., Haifa Bay 26120).
A
los 42 días se determinó la supervivencia (%) de las plantas como el
cociente del número de plantas vivas al finalizar esta etapa entre el
número inicial de plantas (30 plantas). Además, se evaluaron los
indicadores morfológicos: masa fresca (g), masa seca (g), longitud de la
planta (cm), número de hojas, longitud de la raíz más larga (cm) y
número de raíces por planta.
Comparación del extracto acuoso de hojas de moringa y el Previcur® Energy LS 84 en la aclimatización de plantas de piñaSe
diseñaron cuatro tratamientos: raíces sumergidas en agua destilada
durante 72 horas (control), raíces sumergidas en extracto de moringa
diluido ocho veces (1:8) durante 72 horas, raíces sumergidas en Previcur® Energy LS 84 (Bayer CropScience, 1.0 ml·L-1)
durante tres minutos y una combinación de inmersión de las raíces en
extracto de moringa diluido ocho veces (1:8) durante 72 horas y luego en
Previcur Energy® durante tres minutos 22.
Las
plantas fueron sembradas y cultivadas en las mismas condiciones que en
el experimento anterior. A los 42 días se evaluaron los mismos
indicadores descritos en el experimento anterior.
Análisis estadísticoEn
el procesamiento estadístico de los datos se utilizó el utilitario SPSS
Version 21 para Windows, SPSS Inc. Se utilizó el análisis de varianza
(ANOVA) simple y bifactorial (tiempo de inmersión y la dilución del
extracto acuoso). Las medias de los tratamientos se compararon
utilizando la prueba de rangos múltiple de Tukey (p<0,05) previa
comprobación de los supuestos de normalidad y homogeneidad de varianzas.
En los indicadores supervivencia, número de hojas y número de raíces
fue necesaria la transformación de los datos para lograr los supuestos
de las pruebas paramétricas realizadas. En ambos experimentos se
utilizaron 30 plantas por tratamiento con un diseño experimental
completamente aleatorizado. Los experimentos se repitieron tres veces.
El porcentaje de supervivencia representa el promedio de las tres
repeticiones (n=3). Para el resto de los indicadores evaluados cada
planta fue considerada como una unidad experimental y representa el
promedio de todas las mediciones individuales (n=90).
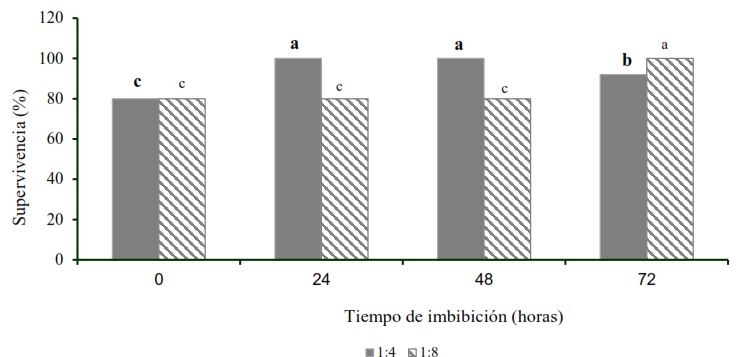
RESULTADOS Y DISCUSIÓNEfecto de la concentración y el tiempo de inmersión en el extracto acuoso de moringa en la aclimatización de plantas de piñaLa Figura 1
muestra la supervivencia de plantas de piña luego de 42 días en
aclimatización, posterior a la inmersión de las plantas en extracto de Moringa oleifera
Lam diluido cuatro (1:4) y ocho veces (1:8) durante 24, 48 y 72 horas.
Los mejores resultados se obtuvieron con la inmersión de las raíces de
las plantas de piña por 24 y 48 horas en el extracto acuoso diluido 1:4,
sin diferencias significativas con la dilución 1:8 por 72 horas. En
estos tratamientos se logró el 100 % de supervivencia de las plantas.
Por otra parte, las plantas cuyas raíces fueron sumergidas en extracto
acuoso de moringa (1:4) por 72 horas, disminuyeron significativamente su
porcentaje de supervivencia. Sin embargo, la dilución (1:8) necesitó 72
horas de inmersión para proporcionar un 100 % de supervivencia.
Efecto del tiempo de inmersión de las raíces de las plantas de Ananas comosus var. comosus ‘MD-2’ en diluciones del extracto acuoso de hojas de Moringa oleifera Lam. cv Supergenius en la supervivencia a los 42 días en condiciones ambientales controladas
Medias con letras desiguales difieren estadísticamente (n=3, ANOVA bifactorial; Tukey; p≤0,05)
Para el tratamiento estadístico, los datos se transformaron de acuerdo con x´= 2arcoseno (x/100)0,5. ESx=16,2. Los datos que se presentan en la figura son no transformados
En las plantas que murieron durante el
experimento se observó flacidez en las hojas con síntomas de pudrición y
coloración parda-negruzca hacia la base de las hojas. Esto pudiera
estar asociado a la presencia de Phytophthora parasitica Dastur que es el principal patógeno que afecta al cultivo de la piña ‘MD-2’ durante la aclimatización 16.
No obstante, es necesaria la realización de análisis de laboratorio que
permitan identificar si los daños se deben a la presencia de este
patógeno.
La Tabla 3 muestra los
valores de los indicadores morfológicos de las plantas de piña como
respuesta a diferentes tiempos de inmersión en diluciones del extracto
acuoso de hojas de moringa. El número de hojas y la masa fresca fueron
significativamente superior cuando las plantas se sumergieron por 72
horas en extracto diluido 1:8, sin diferencias estadísticas con el resto
de los tratamientos donde se utilizó el extracto acuoso de hojas de
moringa, independientemente de la dilución y el tiempo de inmersión. La
longitud de la planta alcanzó los mayores valores cuando se utilizó el
extracto diluido 1:4 por 48 horas y el extracto diluido 1:8 por 72
horas, sin diferencias estadísticas con los tratamientos donde se
utilizó el extracto acuoso de hojas de moringa independientemente del
tiempo de inmersión. La longitud de la raíz más larga fue mayor cuando
la inmersión en el extracto acuoso de hojas de moringa se realizó por 48
y 72 horas, independientemente de la dilución. La masa seca no mostró
diferencias significativas entre las diluciones utilizadas, excepto
cuando la inmersión se realizó en la dilución 1:4 por 72 horas. El
número de raíces no mostró diferencia entre los tratamientos.
El hecho de que la inmersión en la mayor
dilución del extracto acuoso de moringa (1:8) a las 72 horas mostrara
los mejores resultados, en cuanto a la supervivencia y los indicadores
morfológicos, pudiera estar relacionada con que la viscosidad de esta
disolución es menor, lo que favorece la entrada del agua y la
penetración de iones minerales y otros nutrientes que benefician el
crecimiento. Por esta razón, se seleccionó este tratamiento para
continuar la experimentación debido a que la supervivencia y los
indicadores morfológicos evaluados en las plantas mostraron una calidad
superior.
Comparación del extracto acuoso de hojas de moringa y el Previcur® Energy LS 84 en la aclimatización de plantas de piñaLuego de 42 días de cultivo, la supervivencia de las plantas tratadas con Previcur®Energy
LS 84, extracto acuoso diluido ocho veces (1:8) y la combinación de
ambos fue de 100 %; mientras que la del tratamiento control de 81 %
(datos no mostrados).
En la Tabla 4
se muestran los valores de los indicadores morfológicos de las plantas
de piña como respuesta a la inmersión, previo a la aclimatización en el
extracto acuoso de hojas de Moringa oleifera Lam. y en el Previcur®
Energy LS 84. La longitud de la planta y la longitud de la raíz más
larga fueron superiores en las plantas tratadas con Previcur®Energy
LS 84, sin diferencias significativas con el extracto acuoso diluido
1:8. La masa fresca mostró los mejores resultados en los tratamientos
con Previcur®Energy LS 84 y el extracto acuoso diluido 1:8,
sin diferencias significativas con el control. Los indicadores número de
hojas, número de raíces y la masa seca no mostraron diferencias para
los tratamientos evaluados.
Los indicadores morfológicos de las plantas
que se trataron con la inmersión durante 72 horas en extracto acuoso
diluido 1:8 seguido de tres minutos en Previcur®Energy LS 84
se vieron afectados. Es posible que los compuestos fenólicos y los
aminoácidos aromáticos de las proteínas presentes en el extracto crudo
de hojas de moringa interactuaran con el ingrediente activo del Previcur®Energy
LS 84 (propamocarb fosetilato) generando compuestos químicos del tipo
de los fenilcarbamatos. Estos compuestos son reconocidos por tener
actividad herbicida y pueden actuar como inhibidores de la mitosis o del
transporte de electrones en los cloroplastos afectando del crecimiento
de las plantas 23.
Los
resultados de esta investigación demostraron el efecto beneficioso del
extracto acuoso de hojas de moringa sobre los indicadores morfológicos
en la aclimatización de la piña ‘MD-2’. El contacto directo del extracto
acuoso de hojas de moringa por 72 horas con las estructuras absorbentes
de las raíces de las plantas de piña ‘MD-2’ pudo haber favorecido la
entrada de minerales y compuestos orgánicos presentes en el extracto.
Algunos autores reconocen el efecto estimulador del crecimiento de los
extractos crudos acuosos de hojas de Moringa oleifera Lam., asociado a la presencia de aminoácidos, iones minerales como K+ y Ca2+, ácido ascórbico y compuestos fenólicos 24.
Además, cuando se aplicó el extracto acuoso diluido 1:8, el Previcur®Energy
LS 84 y la combinación de ambos tratamientos no se notaron síntomas
visibles de enfermedades fungosas que aparecen en esta etapa crucial de
la aclimatización, donde se reconoce que la mayor mortalidad de las
plantas está asociada a Phytophthora parasitica Dastur 16. Este comportamiento observado con el extracto acuoso pudiera estar asociado a la presencia de compuestos fenólicos (Tabla 1), los que poseen reconocida actividad antimicrobiana 25.
CONCLUSIONESEl
extracto acuoso de hojas de moringa favoreció la etapa inicial de la
aclimatización de la piña ‘MD-2’. La inmersión de las raíces de las
plantas de piña por 72 horas en extracto acuoso diluido ocho veces (1:8)
benefició el crecimiento de las plantas y no se apreciaron diferencias
con el Previcur®Energy LS 84.
AGRADECIMIENTOSLas
investigaciones se realizaron en el marco del proyecto nacional
P131LH003028 “Obtención de extractos vegetales bioactivos, ricos en
metabolitos secundarios para el control de plagas y enfermedades de
cultivos de importancia agrícola”, coordinado por la Dra. Martha
Hernández de la Torre. Los autores agradecen la contribución al trabajo
del Lic. Arturo Matos Ruíz.
BIBLIOGRAFÍA
1.
Gopalakrishnan L, Doriya K, Kumar DS. Moringa oleifera: a review on
nutritive importance and its medicinal application. Food Science and
Human Wellness. 2016;5(2):49-56. doi:10.1016/j.fshw.2016.04.001
2.
Leone A, Spada A, Battezzati A, Schiraldi A, Aristil J, Bertoli S.
Moringa oleifera seeds and oil: characteristics and uses for human
health. International Journal of Molecular Sciences.
2016;17(12):2141-54. doi:10.3390/ijms17122141
3.
Nadeem M, Imran M. Promising features of Moringa oleifera oil: recent
updates and perspectives. Lipids in Health and Disease.
2016;15(1):212-20. doi:10.1186/s12944-016-0379-0
4.
Sumathy R, Vijalakshmi M, Deecaraman M, Sankaranarayanan S, Bama P,
Ramachandran J. Screening of secondary metabolites antioxidant and
antimicrobial activity from the petals of Moringa oleifera. World
Journal of Pharmacy and Pharmaceutical Sciences. 2014;3(6):1829-43.
5.
Iqbal MA, Manan Saleem A, Ahmad B. Effect of seed invigoration
techniques on germination and seedling growth of chinese sweet sorghum.
Zenodo. 2015;2(2):1-4. doi:10.5281/zenodo.999917
6.
Emongor VE. Effects of moringa (Moringa oleifera) leaf extract on
growth, yield and yield components of snap beans (Phaseolus vulgaris).
British Journal of Applied Science & Technology. 2015;6(2):114-22.
doi:10.9734/BJAST/2015/14795
7.
Yasmeen A, Basra SMA, Wahid A, Nouman W, REHMAN HU. Exploring the
potential of Moringa oleifera leaf extract (MLE) as a seed priming agent
in improving wheat performance. Turkish Journal of Botany.
2013;37(3):512-20. doi:10.3906/bot-1205-19
8.
Al_husnan LA, Alkahtani MDF. Impact of moringa aqueous extract on
pathogenic bacteria and fungi in vitro. Annals of Agricultural Sciences.
2016;61(2):247-50. doi:10.1016/j.aoas.2016.06.003
9.
Chiejina NV, Onaebi CN. Phytochemical constituents and antifungal
properties of Chromolaena odorata L. and Moringa oleifera Lam on fungal
rot of cucumber (Cucumis sativus L.) fruit. Asian Journal of Plant
Sciences. 2016;15(1-2):35-41. doi:10.3923/ajps.2016.35.41
10.
Goss M, Mafongoya P, Gubba A. Moringa oleifera extracts effect on
Fusarium solani and Rhizoctonia solani Growth. Asian Research Journal of
Agriculture. 2017;6(1):1-10. doi:10.9734/ARJA/2017/29835
11. Bartholomew DP. MD-2'pineapple transforms the world's pineapple fresh fruit export industry. Pineapple News. 2009;16(8):2-5.
13. Amar AT, Tong PS, Ng C. The MD2' Sper Sweet'pineapple (Ananas comosus). UTAR Agriculture Science Journal. 2015;1(4):14-7.
14.
Sahu J, Sahu RK. A review on low cost methods for in vitro
micropropagation of plant through tissue culture technique. UK Journal
of Pharmaceutical Biosciences. 2013;1(1):38-41.
doi:10.20510/ukjpb/1/i1/91115
15.
Escalona M, Lorenzo JC, González B, Daquinta M, González JL, Desjardins
Y, et al. Pineapple (Ananas comosus L. Merr) micropropagation in
temporary immersion systems. Plant Cell Reports. 1999;18(9):743-8.
doi:10.1007/s002990050653
16.
Hernández A, Muiño B, Rosón C, Cazola C. Hongos y oomycetes
fitopatógenos en viveros de piña Ananas comosus (L.) Merril en Ciego de
Ávila, Cuba. Fitosanidad. 2011;15(3):137-42.
17.
Murashige T, Skoog F. A revised medium for rapid growth and bio assays
with tobacco tissue cultures. Physiologia plantarum. 1962;15(3):473-97.
doi:10.1111/j.1399-3054.1962.tb08052.x
18.
Bradford MM. A rapid and sensitive method for the quantitation of
microgram quantities of protein utilizing the principle of protein-dye
binding. Analytical Biochemistry. 1976;72:248-54.
19.
Dubois M, Gilles KA, Hamilton JK, Rebers P t, Smith F. Colorimetric
method for determination of sugars and related substances. Analytical
Chemistry. 1956;28(3):350-6. doi:10.1021/ac60111a017
20.
Gurr SI, McPherson J, Bowles DJ. Lignin and associated phenolic acids
in cell walls. In: Gurr S., McPherson J, Bowles DJ, editors. Molecular
Plant Pathology and Practical Approach. Oxford , England: Oxford
University Press; 1992. p. 51-6.
21.
Villalobo A, González J, Santos R, Rodríguez R. Morpho-physiological
changes in pineapple plantlets [Ananas comosus (L.) Merr.] during
acclimatization. Ciência e Agrotecnologia. 2012;36(6):624-30.
doi:10.1590/S1413-70542012000600004
22.
Pino Y, Concepción OR, Santos R, González JL, Rodríguez R. Effect of
previcur(r) energy fungicide on MD-2 pineapple (Ananas comosus var.
comosus) plantlets during the acclimatization phase. Pineapple News.
2014;(21):24-6.
23.
Moreland DE. Biochemical mechanisms of action of herbicides and the
impact of biotechnology on the development of herbicides. Journal of
Pesticide Science. 1999;24(3):299-307. doi:10.1584/jpestics.24.299
24.
Ashfaq M (University of A, Basra SMA (University of A, Ashfaq U
(Government CU. Moringa: a miracle plant for agro-forestry. Journal of
Agriculture and Social Sciences (Pakistan). 2012;8(3):115-22.
25.
El-Mohamedy RSR, Abdalla AM. Evaluation of antifungal activity of
Moringa oleifera extracts as natural fungicide against some plant
pathogenic fungi in vitro. International Journal of Agricultural
Technology. 2014;10(4):963-82.
Traducir DocumentoOriginal ArticleEffect of foliar aqueous extract of moringa in the initial acclimatization phase of pineapple
Lianny Pérez-Gómez [1] [*]
Iris Capote-Betancourt [1]
Lelurlys Nápoles-Borrero [1]
Claudia Linares-Rivero [1]
Maritza Escalona-Morgado [1]
Romelio Rodríguez-Sánchez [1]
Aurora Terylene Pérez-Martínez [1]
[1] Centro de Bioplantas. Universidad de Ciego de Ávila Máximo Gómez Báez, Cuba. CP 69450
[*] Author for correspondence. lianny@bioplantas.cu
ABSTRACTMoringa oleifera Lam.
leaves have several chemical constituents such as: amino acids, mineral
ions, ascorbate, phytohormones and secondary metabolites. Consequently,
these extracts can be used to improve growth in other plants. In
addition, it is awarded antimicrobial activity against pathogens of
agricultural interest. The objective of this work was to evaluate the
effect of the aqueous extract obtained from moringa leaves on the
morphological changes of the Ananas comosus var. comosus ‘MD-2’
plant in the initial stage of acclimatization. It was evaluated the
effect of the concentration (dilutions of 1:4 and 1:8) and the immersion
time (0, 24, 48 and 72 hours) in the aqueous extract of moringa
previous to the acclimatization of pineapple seedlings. The aqueous
extract of moringa and Previcur® Energy LS 84 was compared in
the acclimatization of pineapple seedlings. It was achieved 100 %
survival with the immersion of the pineapple seedlings for 24 and 48
hours in aqueous extract diluted 1:4 and for 72 hours in aqueous extract
diluted 1:8. Morphological indicators were higher with the immersion of
pineapple seedlings for 72 hours in aqueous extract diluted 1:8, after
42 days in acclimatization. Significant differences weren’t observed in
morphological indicators for treated plants only with Previcur® Energy LS 84 and aqueous extract diluted 1:8. In these treatments weren’t observed visible symptoms of diseases.
INTRODUCTIONIn recent years, the Moringa oleifera
Lam., has been widely used in human and animal nutrition, in
traditional medicine, in the production of biodiesel and in the
pharmaceutical and cosmetic industry 1-3.
In addition, their extracts are attributed biostimulant activity
because they are rich in amino acids, mineral ions, ascorbate, and
phytohormones 4,5.
This makes it favor the growth of some plants, which allows its use in
different branches of agriculture. However, in most studies, extracts of
moringa leaves have been used to stimulate germination of legume and
cereal seeds, as well as to evaluate their effect on plant growth and
development 6,7.
The presence in moringa extracts of phytochemicals such as coumarins,
flavonoids, terpenoids, carotenoids, tannins and phenolic compounds
confers antimicrobial activity against pathogens of agricultural
interest 8-10.
The pineapple (Ananas comosus
var. Comosus) is the third fruit with the highest production in the
world. It has a pleasant taste and aroma, as well as vitamins C, B1, B6,
folic acid and minerals such as K+ (11. In 2016, its global production amounted to 25,809,038 tons and in Cuba to 48,501 tons 12.
For pineapple producing countries and in particular for Cuba, the
deficiency of propagation material is a problem that arises when it is
desired to promote new areas or introduce a new variety.
The
hybrid 'MD-2' has characteristics of great economic importance, such as
high yields and the quality of the fruit. It is one of the cultivars
with the highest import volumes as fresh fruit in the markets of the
United States and the European Union 13.
However, plants grown in the field average only two propagules per
productive cycle. This makes it necessary to establish schemes for the
production of seeds through biotechnology and to evaluate their
introduction in the conditions of Cuba and specifically in Ciego de
Ávila territory.
The development of
micropropagation techniques has had highly advantageous results in the
rapid and quality propagation of several economically important plant
species 14. In this environment, the
Bioplant Center developed a micropropagation protocol based on the use
of liquid medium and temporary immersion technology together with the
implementation of a semi-automated system 15,
which makes it possible to reduce the time needed to generate
sufficient quantities of vitroplants destined to the creation of basic
seeds banks that allow the promotion of pineapple plantations with high
quality seed.
Acclimatization is due to the fact
that the plants undergo physiological changes that can influence the
following stages. The pineapple has a slow growth, which delays the
duration of this phase. In addition, pineapple plants during
acclimatization can be affected by oomycetes and phytopathogenic fungi,
mainly of the genus Phytophtora, Fusarium and Rhizoctonia, producing important losses 16.
The objective of this work was to evaluate the effect of aqueous extract obtained from leaves of Moringa oleifera Lam. in the morphological changes of the pineapple plants 'MD-2' in the initial stage of acclimatization.
MATERIALS AND METHIDSPlant materialThe plant material of pineapple (Ananas comosus
var. Comosus) 'MD-2' was supplied by the Technological Scaling and
Transfer Laboratory of the Bioplant Center. Plants that came from the in
vitro rooting stage (30 days) and were in a culture medium containing:
MS salts 17, 100 mg L-1 of myo-inositol, sucrose at 30 g L-1, were used. , 1 mg L-1 of thiamin-HCl and 2.69 μmol L-1 of naphthalene acetic acid (ANA).
Obtaining and characterization of the aqueous extract of moringa leavesTo obtain the aqueous extract, the leaves of Moringa oleifera
Lam were used. cv. Supergenius from adult plants of three years grown
in the “Juan Tomás Roig” Experimental Station, Center of Bioplants that
possessed the phytochemical components shown in Table 1.
To obtain the aqueous extract, 400 g of
fresh mass of moringa leaves were milled with liquid nitrogen in a
commercial blender. The proportion of plant material and water was 1:2.5
(m:v). The extraction was carried out for one hour with agitation and
then filtered with gauze to eliminate the plant material. Next, the
sample was centrifuged for 20 minutes at 15,000 x g and the supernatant
was collected. The concentration of proteins 18, the concentration of carbohydrates 19 and the concentration of soluble phenolic compounds 20 were determined to the aqueous extract and are shown in Table 2.
Effect of concentration and time immersion in aqueous extract of moringa in the acclimatization of pineapple plantsHomogeneous plants rooted in vitro
were selected for acclimatization, which had between 0.8-1.62 g of
fresh mass, 8-10 cm in length, 4-6 leaves and 3-4 roots, as established
in the technical instructions for the propagation of the pineapple of
the Bioplants Center 21. Two solutions of
the aqueous extract of moringa were prepared: extract diluted four times
(1: 4) and extract diluted eight times (1: 8). The roots of the plants
were submerged during: 0, 24, 48 and 72 hours in the solutions. 7.5 mL
of the dilutions of the aqueous extract/plant were used.
They
were placed for the duration of the immersion in culture chambers
(KOXKA, mod EC-1200F) with controlled environmental conditions.
Temperature (25±1 °C), photosynthetic photon flux (PPF = 80 mol m-2s-1)
and relative humidity (RH = 70 %) were fixed throughout the experiment
to promote crop growth, photoperiod it was of 16 light hours and eight
hours of darkness.
The plants were planted in plastic containers with a volume of 222.59 cm3
with a mixture of the sifted substrate of Ferralitic Red soil and
filter cake (derived from sugarcane) at a ratio of 1: 1 (v/v). They were
acclimatized in a house of culture under conditions of 80 ± 3 %
relative humidity, 30 ± 2 °C temperature, natural light with
photosynthetic photon flux of 400 ± 25 umol m-2s-1 and atmospheric conditions of concentration of CO2
and natural photoperiod. These were sprayed every 10 days with a foliar
fertilizer mixture containing 16.0 g of crystalline N-P-K and 1.0 g of
Multimicro Combi (Haifa Chemicals Ltd., Haifa Bay 26120).
At
42 days the survival (%) of the plants was determined as the quotient
of the number of live plants at the end of this stage between the
initial numbers of plants (30 plants). In addition, the morphological
indicators were evaluated: fresh mass (g), dry mass (g), length of the
plant (cm), number of leaves, length of the longest root (cm) and number
of roots per plant.
Comparison of the aqueous abstract of moringa leaves and the Previcur® Energy LS 84 in the aclimation of pineapple plantsFour
treatments were designed: roots submerged in distilled water for 72
hours (control), roots submerged in moringa extract diluted eight times
(1: 8) for 72 hours, roots submerged in Previcur® Energy LS 84 (Bayer CropScience, 1.0 ml) L-1)
for three minutes and a combination of immersion of the roots in
moringa extract diluted eight times (1:8) for 72 hours and then in
Previcur Energy® for three minutes 22.
The
plants were sown and cultivated under the same conditions as in the
previous experiment. At 42 days, the same indicators described in the
previous experiment were evaluated.
Statistical analysisIn
the statistical processing of the data, the utility SPSS Version 21 for
Windows, SPSS Inc. was used. The analysis of variance (ANOVA) simple
and bifactorial (immersion time and dilution of the aqueous extract) was
used. The means of the treatments were compared using Tukey's multiple
range test (p <0.05) after checking the assumptions of normality and
homogeneity of variances. In the indicators survival, number of leaves
and number of roots it was necessary to transform the data to achieve
the assumptions of the parametric tests carried out. In both
experiments, 30 plants were used per treatment with a completely
randomized experimental design. The experiments were repeated three
times. The percentage of survival represents the average of the three
repetitions (n=3). For the rest of the indicators evaluated, each plant
was considered as an experimental unit and represents the average of all
the individual measurements (n=90).
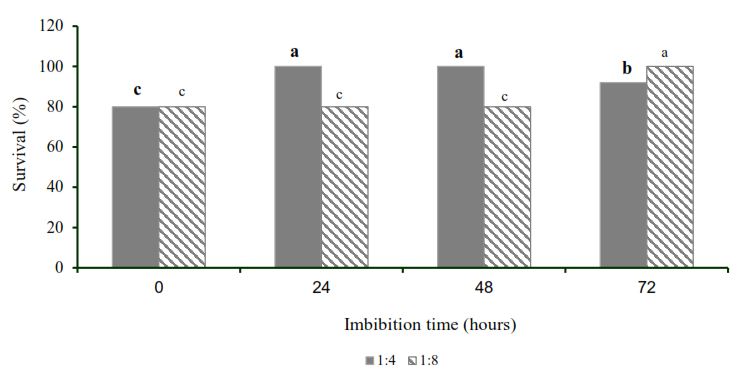
RESULTS AND DISCUSSIONEffect of the concentration and immersion time in the aqueous extract of moringa in the aclimatization of pinapple plantsThe Figure 1 shows the survival of pineapple plants after 42 days in acclimatization, after immersion of the plants in extract of Moringa oleifera
Lam diluted four (1:4) and eight times (1:8) during 24, 48 and 72
hours. The best results were obtained with the immersion of the roots of
the pineapple plants for 24 and 48 hours in the aqueous extract diluted
1: 4, without significant differences with the dilution 1: 8 for 72
hours. In these treatments 100 % survival of the plants was achieved. On
the other hand, the plants whose roots were submerged in aqueous
extract of moringa (1: 4) for 72 hours, significantly decreased their
percentage of survival. However, the dilution (1:8) required 72 hours of
immersion to provide 100 % survival.
Averages
with unequal letters differ statistically (n = 3, bifactorial ANOVA,
Tukey, p≤0.05)For the statistical treatment, the data were transformed
according to x'= 2arcosine (x / 100) 0.5. ESx = 16.2. The data presented
in the figure are not transformed
Effect of the time of immersion of the roots of the plants of Ananas comosus var. Comosus 'MD-2' in dilutions of the aqueous extract of leaves of Moringa oleifera Lam. cv Supergenius in survival at 42 days under controlled environmental conditions
Plants that died during the experiment
showed flaccidity in the leaves with symptoms of rot and brownish-black
coloration towards the base of the leaves. This could be associated with
the presence of Phytophthora parasitica Dastur, which is the main pathogen that affects the cultivation of the 'MD-2' pineapple during acclimatization 16. However, it is necessary to perform laboratory analyzes to identify if the damage is due to the presence of this pathogen.
Table 3 shows the values of the morphological
indicators of the pineapple plants in response to different immersion
times in dilutions of the aqueous extract of moringa leaves. The number
of leaves and the fresh mass were significantly higher when the plants
were submerged for 72 hours in a diluted 1: 8 extract, without
statistical differences with the rest of the treatments where the
aqueous extract of moringa leaves was used, regardless of the dilution
and the time of immersion. The length of the plant reached the highest
values when the diluted extract was used 1: 4 for 48 hours and the
extract diluted 1:8 for 72 hours, without statistical differences with
the treatments where the aqueous extract of moringa leaves was used
regardless of Immersion time. The length of the longest root was greater
when the immersion in the aqueous extract of moringa leaves was carried
out for 48 and 72 hours, independently of the dilution. The dry mass
did not show significant differences between the dilutions used, except
when the immersion was performed in the 1: 4 dilution for 72 hours. The
number of roots showed no difference between the treatments.
The fact that the immersion in the highest
dilution of the aqueous moringa extract (1:8) at 72 hours showed the
best results in terms of survival and the morphological indicators could
be related to the lower viscosity of this solution, which favors the
entry of water and the penetration of mineral ions and other nutrients
that benefit growth. For this reason, this treatment was selected to
continue the experimentation because the survival and the morphological
indicators evaluated in the plants showed a superior quality.
Comparison of the aqueous abstract of moringa leaves and the Previcur® Energy LS 84 in the aclimation of pineapple plantsAfter 42 days of culture, the survival of the plants treated with Previcur®
Energy LS 84, aqueous extract diluted eight times (1:8) and the
combination of both was 100 %; while that of the control treatment of 81
% (data not shown).
Table 4 shows the values of the morphological
indicators of pineapple plants as a response to immersion prior to
acclimatization in the aqueous extract of Moringa oleifera Lam. leaves and in the Previcur® Energy LS 84. The length of the plant and the length of the longest root were higher in the plants treated with Previcur®
Energy LS 84, without significant differences with the aqueous extract
diluted 1: 8. The fresh mass showed the best results in the treatments
with Previcur® Energy LS 84 and the aqueous extract diluted
1:8, without significant differences with the control. The indicators
number of leaves, number of roots and dry mass did not show differences
for the treatments evaluated.
The morphological indicators of the plants
that were treated with immersion for 72 hours in aqueous extract diluted
1: 8 followed by three minutes in Previcur® Energy LS 84
were affected. It is possible that the phenolic compounds and the
aromatic amino acids of the proteins present in the raw extract of
moringa leaves interacted with the active ingredient of Previcur®
Energy LS 84 (propamocarb fosetilate) generating chemical compounds of
the phenylcarbamate type. These compounds are known to have herbicidal
activity and can act as inhibitors of mitosis or electron transport in
chloroplasts affecting the growth of plants 23.
The
results of this investigation showed the beneficial effect of the
aqueous extract of moringa leaves on the morphological indicators in the
acclimatization of the 'MD-2' pineapple. The direct contact of the
aqueous extract of moringa leaves for 72 hours with the absorbent
structures of the roots of the pineapple plants 'MD-2' could have
favored the entry of minerals and organic compounds present in the
extract. Some authors recognize the stimulatory effect of the growth of
aqueous extracts of leaves of Moringa oleifera Lam., associated with the presence of amino acids, mineral ions such as K+ and Ca2 +, ascorbic acid and phenolic compounds 24.
In addition, when the aqueous extract diluted 1: 8 was applied, the Previcur®
Energy LS 84 and the combination of both treatments showed no visible
symptoms of fungal diseases that appear at this crucial stage of
acclimatization, where it is recognized that the highest mortality of
plants is associated with Phytophthora parasitica Dastur 16. This behavior observed with the aqueous extract could be associated with the presence of phenolic compounds (Table 1), which have recognized antimicrobial activity 25.
CONCLUSIONSThe
aqueous extract of moringa leaves favored the initial stage of the
acclimatization of the 'MD-2' pineapple. The immersion of the roots of
the pineapple plants for 72 hours in an aqueous extract diluted eight
times (1: 8) benefited the growth of the plants and no differences were
seen with the Previcur® Energy LS 84.