Translate PaperComunicación cortaEl gen Php no es una fuente de resistencia en el tabaco cubano
Javier Martínez-Pacheco [1] [*]
María del Carmen Castro-Férnandez [1]
Angélica González-Toledo [2]
Verónica Toledo-Sampedro [1]
[1] Departamento
de Genética y Fitopatología, Instituto de Investigaciones del Tabaco,
Carretera a Tumbadero, km 8 ½, San Antonio de los Baños, Artemisa, Cuba.
CP 38100
[2]
Departamento de Biología Vegetal, Facultad de Biología, Universidad de
La Habana, calle 25 No.455 e/ J e I, Vedado, Plaza de la Revolución, La
Habana, Cuba, CP 10400
[*] Autor para correspondencia. jmartinez.iit@gmail.com
RESUMENLa “pata prieta”
es una de las enfermedades principales que afectan a las plantaciones
comerciales de tabaco en el mundo. La identificación de genes de tabaco
involucrados en la resistencia a la enfermedad, así como su inclusión en
las variedades comerciales, constituye un reto importante en la
actualidad para los programas de mejora en Cuba. La información sobre el
“pedigree” de los cultivares cubanos es escaso y en ocasiones
erróneo, por lo que es importante determinar con herramientas
moleculares las fuentes de resistencia a la “pata prieta” en el tabaco
comercial de Cuba. El objetivo de este trabajo fue determinar la
presencia del gen Php, como fuente de resistencia monogénica a la
enfermedad en 29 cultivares de tabaco, mediante el uso de un marcador
molecular específico. Se demostró que el gen Php estaba ausente
en todos los cultivares y que no ha sido introducido a través de
programas de mejora durante años. Resulta importante introducir el gen Php
en nuevos cultivares de tabaco cubano mediante esquemas de piramidación
génica, que permitan su combinación con otras fuentes de resistencia
poligénica, para hacer más durable la resistencia y que tenga un mayor
espectro.
INTRODUCCIÓNLa enfermedad conocida como “pata prieta” provocada por el oomycetes Phytophthora nicotianae Breda de Haan, produce cuantiosas pérdidas anuales a la producción de tabaco en Cuba y el resto del mundo 1,2.
El control de esta enfermedad se realiza a través de un manejo
integrado que comprende: la rotación de cultivos, el uso de productos
químicos y las variedades resistentes, siendo esta última la estrategia
más económica y duradera 3,4.
La
obtención de cultivares resistentes a la enfermedad en Cuba, a través
de los programas de mejoramiento genético actuales, resulta en un largo
período de unos 10 o 12 años. Las diferentes razas de este patógeno son
capaces de evolucionar de manera acelerada en cortos periodos de tiempo,
desarrollándose aislados mucho más agresivos 5;
por esta razón, el patógeno logra vencer la resistencia de las nuevas
variedades que se liberan a la producción en solo unos pocos años. A
esto se suma la posible consanguinidad presente en los cultivares debido
al uso recurrente y continuo de los mismos progenitores, que provoca
una baja variabilidad genética a la cual le resulta fácil adaptarse el
patógeno.
Hasta el momento se encuentran bien identificadas cuatro fuentes de resistencia monogénica y multigénica a P. nicotianae.
La resistencia parcial, controlada por múltiples genes y raza no
específica, que proviene del cultivar 'Florida 301', es una de las más
difundidas pero se asocia a bajos rendimientos y a una reducción de la
calidad de la hoja curada en tabaco Virginia 6.
El
cultivar de tabaco negro 'Beinhart-1000' posee una fuerte resistencia a
las Razas 0 y 1 del patógeno, pero se emplea poco en programas de
mejora por la presencia de compuestos no deseados en la hoja curada 1,7. La región genómica conocida como Wz proveniente de la especie silvestre Nicotiana rustica
ha sido introgresada en algunos cultivares de tabaco Virginia en
Estados Unidos de América y Zimbabwe a través de una línea estable
designada como 'Wz'. Líneas de tabaco, en las cuales ha sido
introgresada la región Wz, contienen un gen o genes que confieren un alto nivel de resistencia a la Raza 0 y afectan la resistencia a la Raza 1 de P. nicotianae7.
Por último, tenemos la transferencia de los genes Php y Phl a cultivares comerciales de tabaco a partir de las especies silvestres Nicotiana plumbaginifolia Viv. y Nicotiana longiflora
Cav., respectivamente. Ambos genes poseen efectos similares, con un
carácter monogénico dominante que aporta resistencia completa solo a la
Raza 0 de P. nicotianae8-12.
En Cuba sólo se informa la presencia de la Raza 0 de P. nicotianae
y los cultivares cubanos muestran niveles de resistencia variables,
desde susceptibles hasta altamente resistentes, en el momento de su
liberación a la producción. 5
Existe ambigüedad entre los productores y fitomejoradores sobre el origen de la resistencia a P. nicotianae en los cultivares de tabaco cubano, por lo que se hace difícil determinar si el gen Php
se introdujo en los cultivares comerciales como parte del programa de
mejoramiento genético en la década de los 60 y 70 del siglo anterior.
Esto impide saber si este gen de resistencia se ha desplegado en el
genofondo del tabaco en Cuba a lo largo de más de 40 años de
mejoramiento genético.
Una búsqueda intensa y rigurosa en el pedigree
de los cultivares comerciales de tabaco cubanos, muestra que
probablemente solo se introdujo en Cuba la resistencia a la “pata
prieta” que proviene de 'Florida 301', a través de cultivares que se
emplearon como progenitores en los programas de mejora. Cultivares como
'K326' y el propio 'Florida 301', se utilizaron en la mejora de
cultivares de tabaco cubano tipo Virginia unos años atrás 13. No tenemos evidencia de la presencia del gen Php
como fuente de resistencia en el tabaco cubano, un conocimiento
fundamental que se necesita para los programas de mejora y para el
establecimiento de una adecuada política varietal de tabaco en nuestro
país.
Tomando en cuenta lo anterior el objetivo de esta investigación fue identificar la presencia del gen Php
en cultivares actuales comerciales de tabaco, cultivares que en su
momento fueron comerciales y cultivares que se han empleado y emplean en
los programas de mejora del tabaco en Cuba como parentales desde hace
más de 40 años.
MATERIALES Y MÉTODOSTodos
los cultivares de esta investigación se utilizaron o utilizan en los
programas de mejora genética del tabaco en Cuba. Se plantaron semillas
de 29 cultivares de tabaco (Nicotiana tabacum L.) y semillas de la especie silvestre Nicotiana plumbaginifolia Viv. (fuente natural del gen Php)
en bandejas de poliestireno expandido, con 264 alveolos, que contenían
sustrato orgánico con la siguiente composición: 70 % de turba negra, 15 %
de cáscara de arroz y 15 % de zeolita 14, basado en la tecnología de bandejas flotantes, según García y Andino 15. Las bandejas se colocaron en condiciones de cultivo protegido o túneles.
Extracción de ADNLa extracción se realizó de hojas jóvenes de plantas de 45 días de edad, según el método del CTAB modificado 16.
Las concentraciones de ADN se determinaron de forma
espectrofotométrica, según las relaciones 260/280 nm y 260/230 nm. La
integridad del ADN se determinó mediante electroforesis en agar al 0,8
%.
Condiciones de la PCREl marcador RAPD, UBC 304908, se utilizó para identificar la presencia del gen Php.
La PCR se realizó en un volumen de 15 µl. Las condiciones consistieron
en 25 ng ADN genómico, 0,4 µM de oligo, tampón de reacción 1X TaqPol
(Promega, EUA), 2,5 mM MgCl2, 200 µM de PCR Nucleotide Mix
(Promega, EUA), y 1.0 U de Taq Polimerasa (Promega, EUA). El programa de
amplificación utilizado fue el de Johnson et al, 2008 8.
Brevemente, la reacción fue desnaturalizada inicialmente a 94 °C por 2
min, seguido por tres ciclos a 94 °C por 1 min, 38 °C por 1 min, y 72 °C
por 2 min; 35 ciclos a 92 °C por 1 min, 40 °C por 1 min, 72 °C por 2
min y un paso de extensión final a 72 °C por 5 min. Diez microlitros de
cada muestra más dos microlitros de Blue/Orange Dye 6x (Promega, EUA) se
cargaron en un gel de agarosa al 1 % y separados a 150 volts por 1 hora
en 1X Tris-Borato-EDTA. El ADN se visualizó con SYBR® Green
Dye (Sigma-Aldrich, EUA), de acuerdo con las especificaciones de los
proveedores y la talla del fragmento, se estimó a partir de un marcador
molecular de 1 kb (Applichem, Alemania). La talla esperada de la banda
para el fragmento ligado al gen Php es de aproximadamente 490 pb 8.
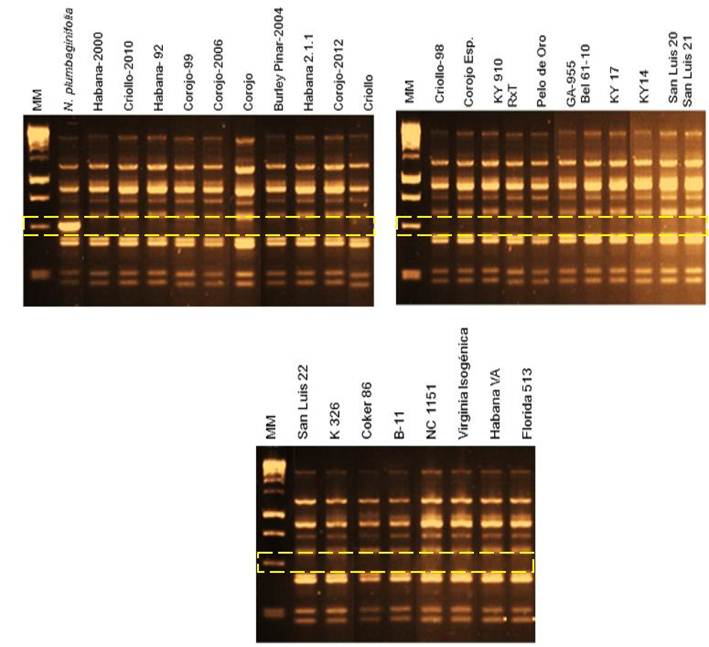
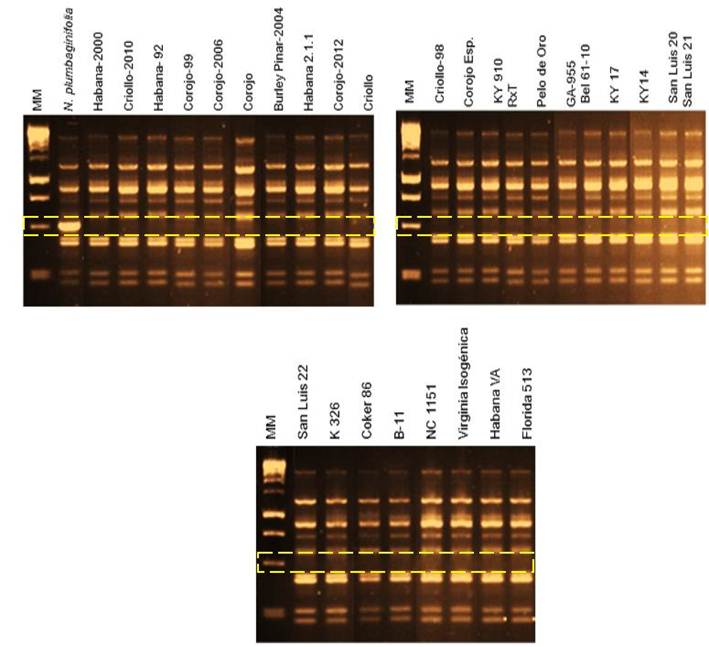
RESULTADOS Y DISCUSIÓNEn todos los cultivares testados está ausente el gen Php, excepto en N. plumbaginifolia que es la fuente natural (Tabla 1 y Figura 1).
Los resultados aportan nueva información que sugiere que estos
cultivares, que se utilizaron como progenitores en los programas de
mejora del tabaco en Cuba a lo largo de más de 40 años, no contienen el
gen Php. Este tipo de resistencia puede introducirse y explotarse
en los actuales y futuros programas de mejora en nuestro país. La
evidencia científica sobre la ausencia de Php en el tabaco
comercial cubano entra en contradicción con lo citado por Espino y
citado por Valdés, que afirma que los cultivares cubanos de tabaco tipo
Virginia poseen la fuente de resistencia a la enfermedad “pata prieta”
que proviene de N. plumbaginifolia17,18. En ninguno de los 10 cultivares de tabaco Virginia que se analizaron se encuentra el gen Php.
Identificación de la presencia/ausencia del marcador UBC30490 en los 29 cultivares analizados y en la especie silvestre N. plumbaginifolia
mediante, electroforesis en agar al 1 %. Nótese que los rectángulos
amarillos de líneas discontinuas señalan la presencia o ausencia de la
banda de talla esperada de 490 pb para el gen Php y que solo aparece en N. plumbaginifolia
Sobre la base de esta nueva evidencia es
posible desarrollar programas de mejora que utilicen como parentales un
cultivar foráneo que tenga el gen Php y un cultivar cubano con
buen desempeño agrícola y elevado rendimiento, para así obtener líneas
y/o cultivares mejorados en cuanto a la resistencia a la “pata prieta”
que posean el típico fenotipo comercial de tabaco cubano muy deseado por
los consumidores de Europa. Debido a la baja durabilidad de los
mecanismos de resistencia monogénica en tabaco 19, los programas deben estar enfocados a combinar la resistencia monogénica del gen Php con niveles medios o altos de resistencia poligénica que resulta más duradera en el tiempo.
Por
esa razón es importante el diseño de esquemas de piramidación génica,
que permitan obtener líneas élites de tabaco en cortos períodos de
tiempo (tres a cinco años), que posean un amplio espectro de respuesta a
las diferentes razas patogénicas de P. nicotianae, como
resultado de la combinación de los tipos de resistencias monogénica y
poligénica, sin afectar significativamente el rendimiento en la
producción.
La existencia de marcadores AFLP, SSR y SCAR para la región genómica Wz, el componente de la resistencia en Beinhart-1000 y el gen Php, respectivamente 1,20,
permiten aplicar métodos de mejora que permitan una selección más
confiable, rápida y segura de las líneas genéticas resistentes. Uno de
estos métodos es el retrocruce asistido por marcadores moleculares, que
hace posible la combinación del gen Php en estado homocigótico o heterocigótico con otras fuentes de resistencia poligénica, como el fragmento genómico Wz en líneas isogénicas cercanas e híbridos isogénicos cercanos.
Se ha demostrado que Php y Wz se segregan de forma independiente y que la combinación de genotipos Wz/-Php/-
exhiben niveles de resistencia a la “pata prieta”, que fueron
significativamente mayores que los exhibidos por cultivares comerciales
de EUA heterocigóticos para el gen Php, como NC 196 y NC 71 7.
En tabaco, la introgresión de genes de resistencia, a partir de
especies silvestres en estado heterocigótico, típicamente exhibe mayor
desempeño agrícola y rendimiento en comparación con materiales en estado
homocigótico 19.
En Cuba solo se informa la presencia de la Raza 0 de P. nicotianae y existe un debate sobre la presencia real de la Raza 1 21. El gen Php
confiere inmunidad solo a la Raza 0, pero hay que tener cuidado con las
líneas que se deriven de estos programas y que contengan este gen en
estado homocigótico o heterocigótico. Es necesario cumplir los esquemas
de rotación con cultivares que no posean el gen o que posean una fuente
de resistencia diferente para evitar un cambio hacia la Raza 1 y la
predominancia final de razas alternativas 11,22.
Todas
las fuentes de resistencia ejercen presión de selección sobre el
patógeno, lo que puede resultar en la selección y establecimiento de
nuevas razas y/o poblaciones de patógenos con una mayor agresividad en
genotipos de huéspedes resistentes 23.
En el tabaco, las poblaciones de P. nicotianae
pueden exhibir mayor agresividad a las plantas con altos niveles de
resistencia parcial, después de unas pocas generaciones de hospederos 22.
Cuando
la resistencia completa se distribuye ampliamente en un área geográfica
grande, conduce a una selección direccional en la población de
patógenos. Esta selección da como resultado un aumento en los mutantes
virulentos y la ruptura del gen de resistencia 22,23.
Por lo tanto, la resistencia completa generalmente no es duradera y, a
menudo, da como resultado ciclos de auge y caída en los que el huésped
se ve favorecido durante un tiempo, seguido de un cambio a favor del
patógeno 23.
En otro
orden, es importante evaluar la calidad química de las nuevas líneas en
términos de porcentaje de alcaloides totales y porcentaje de azúcares
reductores y que estos valores estén dentro del margen comercial
aceptable para el tabaco cubano en el mercado internacional. Las fuentes
de resistencia a la “pata prieta” conocidas, se asocian regularmente
con una reducción de los rendimientos y/o de la calidad de la hoja
curada, lo que hace difícil el desarrollo de cultivares altamente
resistentes, que a la vez produzcan altos rendimientos de hoja curada
con características químicas de calidad adecuada 7.
NotaEste
artículo no cumple con el índice de Price porque que no hay más
bibliografía actualizada disponible. Este gen fue descubierto hace más
de 20 años y debido a que presenta problemas de ligamiento durante los
cruces y en la segregación se ha hecho difícil su estudio y no se ha
podido aislar, secuenciar y/clonar y los genetistas ante estas
dificultades solo han investigado temas superficiales como su
introgresión en cultivares de tabaco susceptibles a la “pata prieta” y
han publicado artículos hace más de 10 años fundamentalmente sobre este
tema en particular. Desde hace años se dejó de publicar en este tema y
se perdió interés por las dificultades anteriormente expuestas y porque
ya se tenían variedades con este gen y por el descubrimiento de nuevas
fuentes de resistencia proveniente de especies silvestres del género
Nicotiana que pueden incluirse en el genoma del tabaco comercial y son
de más fácil estudio.
Pero para Cuba es un tema
completamente nuevo que se está comenzando a explotar en las nuevas
variedades de tabaco cubano como parte de un nuevo manejo integrado de
plagas en el cual los esquemas de piramidación génica durante los
programas de mejora se hacen necesarios para incluir nuevas fuentes de
resistencia monogénica en combinación a otras fuentes de resistencia
poligénica para desarrollar cultivares con un amplio espectro de
resistencia.
Este artículo no cumple con el
índice de Price porque que no hay más bibliografía actualizada
disponible. Este gen fue descubierto hace más de 20 años y debido a que
presenta problemas de ligamiento durante los cruces y en la segregación
se ha hecho difícil su estudio y no se ha podido aislar, secuenciar
y/clonar y los genetistas ante estas dificultades solo han investigado
temas superficiales como su introgresión en cultivares de tabaco
susceptibles a la “pata prieta” y han publicado artículos hace más de 10
años fundamentalmente sobre este tema en particular. Desde hace años se
dejó de publicar en este tema y se perdió interés por las dificultades
anteriormente expuestas y porque ya se tenían variedades con este gen y
por el descubrimiento de nuevas fuentes de resistencia proveniente de
especies silvestres del género Nicotiana que pueden incluirse en el
genoma del tabaco comercial y son de más fácil estudio.
Pero
para Cuba es un tema completamente nuevo que se está comenzando a
explotar en las nuevas variedades de tabaco cubano como parte de un
nuevo manejo integrado de plagas en el cual los esquemas de piramidación
génica durante los programas de mejora se hacen necesarios para incluir
nuevas fuentes de resistencia monogénica en combinación a otras fuentes
de resistencia poligénica para desarrollar cultivares con un amplio
espectro de resistencia.
CONCLUSIONES
En este artículo se demostró, que en los 29 cultivares utilizados, no se ha introgresado el gen Php, por lo que se clarifica que la fuente de resistencia a la “pata prieta” no proviene de Nicotiana plumbaginifolia.
Se
hace necesario introducir este gen en los cultivares comerciales de
tabaco, llevando a cabo una óptima estrategia varietal que los alterne
con otros cultivares que presenten otro tipo de fuente de resistencia,
evitando así la rápida adaptación del patógeno.
Esfuerzos
futuros se deben encaminar en el desarrollo de programas de
piramidación génica, para hacer coincidir más de un tipo diferente de
resistencia a P. nicotianae en un mismo cultivar, siendo de vital importancia como línea base en los programas de mejoramiento genético.
AGRADECIMIENTOSAl
Dr. Juan Luis Pérez Rodríguez, curador del Banco de Germoplasma del
Instituto de Investigaciones del Tabaco, Cuba y a la Dra. Georgina
Espinosa de la Facultad de Biología, Universidad de La Habana.
BIBLIOGRAFÍA
1.
Drake K, Lewis RS. An introgressed nicotiana rustica genomic region
confers resistance to Phytophthora nicotianae in cultivated tobacco.
Crop Science. 2013;53(4):1366-74. doi:10.2135/cropsci2012.10.0605
2.
Toledo V, Quintana F. Efectividad del aceite esencial de Melaleuca
quinquenervia (cav.) para el manejo de enfermedades fúngicas en el
cultivo del tabaco. Cuba Tabaco. 2015;16(1):18-26.
3.
Pacheco JM. Genes involucrados en la resistencia a la pata prieta y
mejoramiento genético en Cuba. Cuba Tabaco. 2015;16(1):69-77.
4.
Liu H, Ma X, Yu H, Fang D, Li Y, Wang X, et al. Genomes and virulence
difference between two physiological races of Phytophthora nicotianae.
GigaScience. 2016;5(3):1-8. doi:10.1186/s13742-016-0108-7
5.
Toledo V. Compatibilidad del control biológico de Trichoderma frente a
fungicidas utilizados en el cultivo del tabaco. Cuba Tabaco. 2014;15(1).
6.
Xiao B, Drake K, Vontimitta V, Tong Z, Zhang X, Li M, et al. Location
of genomic regions contributing to resistance in tobacco cultivar
Florida 301. Crop Science. 2013;53(2):473-81.
doi:10.2135/cropsci2012.06.0376
7.
Drake KE, Moore JM, Bertrand P, Fortnum B, Peterson P, Lewis RS. Black
shank resistance and agronomic performance of flue-cured tobacco lines
and hybrids carrying the introgressed Nicotiana rustica region, Wz. Crop
Science. 2015;55(1):79-86. doi:10.2135/cropsci2014.02.0164
8.
Johnson ES, Wolff MF, Wernsman EA, Rufty RC. Marker-assisted selection
for resistance to black shank disease in tobacco. Plant Disease.
2002;86(12):1303-9. doi:10.1094/PDIS.2002.86.12.1303
9.
Johnson CS, Wernsman EA, LaMondia JA. Effect of a chromosome segment
marked by the Ph p gene for resistance to Phytophthora nicotianae on
reproduction of tobacco cyst nematodes. Plant Disease.
2009;93(3):309-15. doi:10.1094/PDIS-93-3-0309
11.
Li Y, Harris-Shultz K, Wang H, Wadl PA, Ji P. Population structure and
genetic diversity of Phytophthora nicotianae from tobacco in Georgia.
Plant Disease. 2017;101(7):1113-8. doi:10.1094/PDIS-01-17-0142-RE
12.
Parkunan V, Johnson CS, Eisenback JD. Effects of Php gene-associated
versus induced resistance to tobacco cyst nematode in flue-cured
tobacco. Journal of Nematology. 2009;41(4):261-6.
13.
Espino Marrero E, Torrecilla Guerra G. El tabaco cubano. Recursos
fitogenéticos [Internet]. 1ra ed. La Habana, Cuba: Editorial
Científico-Técnica; 1999 [cited 2019 Feb 1]. 231 p. Available from:
http://www.libreroonline.com/cuba/libros/18832/espino-marrero-eumelio-torrecilla-guerra-gilberto/el-tabaco-cubano-recursos-fitogeneticos.html
14.
Hernández Y, León Y, Hernández JM, Monroy AL. Nuevos sustratos para la
producción de plántulas de tabaco en semilleros flotantes. Cuba Tabaco.
2004;5(2):15-9.
15.
García M, Andino V. Tecnología de bandejas flotantes en la producción
de plántulas de tabaco en Cuba. Cuba Tabaco. 2002;3(1):30-3.
16.
Zhang YP, Uyemoto JK, Kirkpatrick BC. A small-scale procedure for
extracting nucleic acids from woody plants infected with various
phytopathogens for PCR assay. Journal of Virological Methods.
1998;71(1):45-50.
17. Espino E. El mejoramiento genético del tabaco (Nicotiana tabacum) en Cuba. Boletín de Reseñas. Tabaco. CU. 1988;(14):3-59.
18.
Valdés de la Cruz M. Caracterización de la variabilidad genética en una
colección de especies del Banco de Germoplasma del género Nicotiana L. en Cuba [Tesis de Doctorado]. [La Habana, Cuba]: Universidad de La Habana; 2010. 127 p.
19.
Ramsey SL. Nicotiana. In: Kole C, editor. Wild Crop Relatives: Genomic
and Breeding Resources: Plantation and Ornamental Crops [Internet].
Berlin Heidelberg: Springer-Verlag; 2011 [cited 01/02/2019]. p. 185-208.
Available from: https://www.springer.com/la/book/9783642212000
20. Vontimitta V, Lewis RS. Mapping of quantitative trait loci affecting resistance to Phytophthora nicotianae in tobacco (Nicotiana tabacum L.) line Beinhart-1000. Molecular Breeding. 2012;29(1):89-98. doi:10.1007/s11032-010-9528-8
21.
Toledo V. Metodología para la diferenciación de la raza 1 y los tres
grupos patogénicos de la raza 0 en los aislamientos de Phytophthora
nicotianae Breda de Haan del tabaco en Cuba. Cuba Tabaco.
2009;10(1):67-71.
22.
McDonald BA, Linde C. The population genetics of plant pathogens and
breeding strategies for durable resistance. Euphytica.
2002;124(2):163-80. doi:10.1023/A:1015678432355
23.
McCorkle K, Lewis R, Shew D. Resistance to Phytophthora nicotianae in
Tobacco Breeding Lines Derived from Variety Beinhart 1000. Plant
Disease. 2013;97(2):252-8. doi:10.1094/PDIS-05-12-0480-RE
INTRODUCTIONThe disease known as “black shank” caused by the oomycetes Phytophthora nicotianae Breda de Haan, produces large annual losses to tobacco production in Cuba and the rest of the world 1,2.
The control of this disease is carried out through an integrated
management that includes: the rotation of crops, the use of chemical
products and resistant varieties, the latter being the most economical
and lasting strategy 3,4.
Obtaining
cultivars resistant to the disease in Cuba, through current breeding
programs results in a long period of about 10 or 12 years. The different
races of this pathogen are able to evolve in an accelerated way in
short periods of time developing much more aggressive isolates 5,
for this reason the pathogen manages to overcome the resistance of the
new varieties that are released to production in only a few years. To
this is added the possible consanguinity present in the cultivars due to
the recurrent and continuous use of the same parents that causes a low
genetic variability to which it is easy to adapt the pathogen.
So far, four sources of monogenic and multigenic resistance to P. nicotianae
are well identified. The partial resistance, controlled by multiple
genes and non-specific race that comes from the cultivar 'Florida 301'
is one of the most widespread but is associated with low yields and a
reduction in the quality of the leaf cured in Virginia tobacco 6.
The
cultivar of black tobacco 'Beinhart-1000' has a strong resistance to
races 0 and 1 of the pathogen, but it is little used in improvement
programs due to the presence of unwanted compounds in the cured leaf 1,7). The genomic region known as Wz from the wild species Nicotiana rustica
has been introgressed in some cultivars of tobacco Virginia in the
United States of America and Zimbabwe through a stable line designated
as' Wz'. Tobacco lines in which it has been introgressed the Wz
region contains a gene or genes that confer a high level of resistance
to Race 0 and affect the resistance to Race 1 of P. nicotianae7.
Finally we have the transfer of Php and Phl genes to commercial tobacco cultivars from the wild species Nicotiana plumbaginifolia Viv. and Nicotiana longiflora
Cav., Respectively. Both genes have similar effects, with a dominant
monogenic character that provides complete resistance only to Race 0 of P. nicotianae8-12.
In Cuba, only the presence of Race 0 of P. nicotianae
is reported and Cuban cultivars show resistance levels varying from
susceptible to highly resistant at the time of release to production. 5
There is ambiguity among producers and plant breeders about the origin of resistance to P. nicotianae in Cuban tobacco cultivars. So it is difficult to determine if the Php
gene was introduced into commercial cultivars as part of the breeding
program in the 60s and 70s of the previous century. This makes it
impossible to know if this resistance gene has been deployed in the set,
properly preserved, of the variety of genes of tobacco in Cuba over
more than 40 years of genetic improvement.
An intense and rigorous search in the pedigree
of Cuban commercial tobacco cultivars shows that probably only
resistance to the "brown leg" that comes from "Florida 301" was
introduced in Cuba through cultivars that were used as progenitors in
the programs of improvement. Cultivars such as 'K326' and 'Florida 301'
itself, were used in the improvement of Cuban tobacco cultivars type
Virginia a few years ago 13. We have no evidence of the presence of the Php
gene as a source of resistance in Cuban tobacco, a fundamental
knowledge that is needed for improvement programs and for the
establishment of an adequate tobacco policy in our country.
Taking into account the above, the objective of this research was to identify the presence of the Php
gene in current commercial tobacco cultivars, cultivars that were
commercial at the time and cultivars that have been used and used in
tobacco improvement programs in Cuba as parents for more than 40 years.
MATERIAL AND METHODSAll the cultivars of this research were used or used in tobacco breeding programs in Cuba. Seeds of 29 tobacco cultivars (Nicotiana tabacum L.) and seeds of the wild species Nicotiana plumbaginifolia Viv. (Natural source of the Php
gene) were planted in expanded polystyrene trays with 264 alveoli
containing organic substrate with the following composition: 70 % of
black peat, 15 % of rice husk and 15 % of zeolite 14, based on the floating tray technology according to García and Andino 15. The trays were placed in protected culture conditions or tunnels.
Extraction of DNAThe extraction was made from young leaves of 45-day-old plants according to the modified CTAB method 16.
The DNA concentrations were determined spectrophotometrically according
to the 260/280 nm and 260/230 nm ratios. The integrity of the DNA was
determined by electrophoresis in 0.8 % agar.
Condiciotions of the PCRThe RAPD marker, UBC 304908, was used to identify the presence of the Php
gene. PCR was performed in a volume of 15 μl. The conditions consisted
of 25 ng genomic DNA, 0.4 μM oligo, 1X TaqPol reaction buffer (Promega,
EUA), 2.5 mM MgCl2, 200 μM PCR Nucleotide Mix (Promega, EUA),
and 1.0 U of Taq Polymerase (Promega, USA). The amplification program
used was that of Johnson et al, 2008 8.
Briefly, the reaction was denatured initially at 94 °C for 2 min,
followed by three cycles at 94 °C for 1 min, 38 °C for 1 min, and 72 °C
for 2 min; 35 cycles at 92 °C for 1 min, 40 °C for 1 min, 72 °C for 2
min and a final extension step at 72 °C for 5 min. Ten microliters of
each sample plus two microliters of Blue/Orange Dye 6x (Promega, USA)
were loaded on a 1 % agarose gel and separated at 150 volts for 1 hour
in 1X Tris-Borate-EDTA. The DNA was visualized with SYBR®
Green Dye (Sigma-Aldrich, USA) according to the specifications of the
suppliers and the size of the fragment was estimated from a molecular
marker of 1 kb (Applichem, Germany). The expected length of the band for
the fragment linked to the Php gene is approximately 490 bp 8.
RESULTS AND DISCUSSIONIn all the cultivars tested, the Php gene is absent except for N. plumbaginifolia, which is the natural source (Table 1 and Figure 1).
The results provide new information that suggests that these cultivars
that were used as progenitors in tobacco improvement programs in Cuba
over more than 40 years do not contain the Php gene. This type of
resistance can be introduced and exploited in current and future
improvement programs in our country. The scientific evidence on the
absence of Php in Cuban commercial tobacco is in contradiction with the
cited by Espino and cited by Valdés, who states that Cuban cultivars of
Virginia-type tobacco possess the source of resistance to the disease
“black shank” that comes from of N. plumbaginifolia17,18. In none of the 10 Virginia tobacco cultivars that were analyzed was the Php gene.
Identification of the presence/absence of marker UBC30490 in the 29 cultivars analyzed and in the wild species N. plumbaginifolia
by electrophoresis in 1 % agar. Note that the yellow rectangles of
dashed lines indicate the presence or absence of the expected length
band of 490 bp for the Php gene and that it only appears in N. plumbaginifolia
On the basis of this new evidence it is
possible to develop improvement programs that use as a parent a foreign
cultivar that has the Php gene and a Cuban cultivar with good
agricultural performance and high yield to obtain lines and cultivars
improved in terms of resistance to the "black shank" that possess the
typical commercial phenotype of Cuban tobacco very much desired by
consumers in Europe. Due to the low durability of the mechanisms of
monogenic resistance in tobacco 19, programs should focus on combining the monogenic resistance of the Php gene with medium or high levels of polygenic resistance that is more durable over time.
For
this reason, it is important to design genetic pyramid schemes that
allow obtaining elite lines of tobacco in short periods of time (three
to five years), that have a broad spectrum of response to the different
pathogenic races of P. nicotianae, as a result of the combination
of monogenic and polygenic types of resistances, without significantly
affecting production performance.
The existence of AFLP, SSR and SCAR markers for the Wz genomic region, the resistance component in Beinhart-1000 and the Php gene, respectively (1.20),
allow the application of improvement methods that allow a more
reliable, quick and safe selection of the resistant genetic lines. One
of these methods is the backcross assisted by molecular markers that
makes it possible to combine the Php gene in a homozygous or heterozygous state with other sources of polygenic resistance such as the Wz genomic fragment in nearby isogenic lines and nearby isogenic hybrids.
It has been shown that Php and Wz
are segregated independently and that the combination of Wz/-Php/ -
genotypes exhibit levels of resistance to the "black shank" that were
significantly higher than those exhibited by commercial cultivars of the
USA heterozygous for the gene Php, as NC 196 and NC 71 7.
In tobacco, the introgression of resistance genes from heterozygous
wild species typically exhibits higher agricultural performance and
yield compared to materials in the homozygous state 19.
In Cuba, only the presence of Race 0 of P. nicotianae is reported and there is a debate about the real presence of Race 1 21. The Php
gene confers immunity only to Race 0, but care must be taken with the
lines that are derived from these programs and that contain this gene in
a homozygous or heterozygous state. It is necessary to comply with
rotation schemes with cultivars that do not have the gene or that have a
different source of resistance to avoid a change to Race 1 and the
final predominance of alternative races 11,22.
All
sources of resistance exert selection pressure on the pathogen, which
may result in the selection and establishment of new races and
populations of pathogens with greater aggressiveness in genotypes of
resistant hosts 23.
In tobacco, populations of P. nicotianae may exhibit greater aggressiveness to plants with high levels of partial resistance after a few generations of hosts 22.
When
complete resistance is widely distributed over a large geographic area,
it leads to a directional selection in the pathogen population. This
selection results in an increase in virulent mutants and breakdown of
the resistance gene 22,23.
Therefore, complete resistance is generally not durable and often
results in boom and bust cycles in which the host is favored for a time
followed by a change in favor of the pathogen 23.
In
another aspect, it is important to evaluate the chemical quality of the
new lines in terms of percentage of total alkaloids and percentage of
reducing sugars and that these values are within the acceptable
commercial margin for Cuban tobacco in the international market. Known
sources of resistance to the "black shank" are regularly associated with
a reduction in the yields and the quality of the cured leaf, which
makes it difficult to develop highly resistant cultivars that also
produce high yields cured leaf with chemical characteristics of adequate
quality 7.
NoteEste
artículo no cumple con el índice de Price porque que no hay más
bibliografía actualizada disponible. Este gen fue descubierto hace más
de 20 años y debido a que presenta problemas de ligamiento durante los
cruces y en la segregación se ha hecho difícil su estudio y no se ha
podido aislar, secuenciar y/clonar y los genetistas ante estas
dificultades solo han investigado temas superficiales como su
introgresión en cultivares de tabaco susceptibles a la “pata prieta” y
han publicado artículos hace más de 10 años fundamentalmente sobre este
tema en particular. Desde hace años se dejó de publicar en este tema y
se perdió interés por las dificultades anteriormente expuestas y porque
ya se tenían variedades con este gen y por el descubrimiento de nuevas
fuentes de resistencia proveniente de especies silvestres del género
Nicotiana que pueden incluirse en el genoma del tabaco comercial y son
de más fácil estudio.
Pero para Cuba es un tema
completamente nuevo que se está comenzando a explotar en las nuevas
variedades de tabaco cubano como parte de un nuevo manejo integrado de
plagas en el cual los esquemas de piramidación génica durante los
programas de mejora se hacen necesarios para incluir nuevas fuentes de
resistencia monogénica en combinación a otras fuentes de resistencia
poligénica para desarrollar cultivares con un amplio espectro de
resistencia.
This article does not meet the
Price index because there is no more updated bibliography available.
This gene was discovered more than 20 years ago and because it presents
problems of linkage during crossings and segregation, it has become
difficult to study and it has not been possible to isolate, sequence and
/ or clone and geneticists faced with these difficulties have only
investigated superficial issues such as its introgression in tobacco
cultivars susceptible to "Pata prieta" and have published articles for
more than 10 years mainly on this particular issue. For years, this
issue has been discontinued and interest has been lost because of the
difficulties described above and because varieties with this gene were
already available and because of the discovery of new sources of
resistance from wild species of the Nicotiana genus that can be included
in the genome of commercial tobacco and are easier to study.
But
for Cuba it is a completely new issue that is beginning to be exploited
in the new varieties of Cuban tobacco as part of a new integrated pest
management in which gene pyramid schemes during breeding programs become
necessary to include new sources. of monogenic resistance in
combination with other sources of polygenic resistance to develop
cultivars with a broad spectrum of resistance.
CONCLUSIONS
In this article it was shown that in the 29 cultivars used the Php gene has not been introgressed, so it is clarified that the source of resistance to the "brown leg" does not come from Nicotiana plumbaginifolia.
It
is necessary to introduce this gene in commercial tobacco cultivars,
carrying out an optimal varietal strategy that alternates with other
cultivars that present another type of resistance source, thus avoiding
the rapid adaptation of the pathogen.
Future
efforts should be directed to the development of genetic pyramid
programs to match more than one different type of resistance to P. nicotianae in the same cultivar, being of vital importance as a baseline in breeding programs.