Efecto de sales de quitosano en la calidad poscosecha del mango ‘Tommy Atkins’
Effect of chitosan salts in post-harvest quality of mango ‘Tommy Atkins’
M.Cs. Tania Mulkay-Vitón
Instituto de Investigaciones en Fruticultura Tropical. Ave 7ma No. 3005 e/ 30 y 32. Playa, CP 11300, Cuba.
RESUMEN
Las frutas de mango son de patrón respiratorio climatérico y la enfermedad por antracnosis afecta su calidad, por lo que la vida de anaquel es corta. Dadas las tendencias del consumo de frutas sin residuos químicos se buscan alternativas para alargar la vida poscosecha, como los productos bioactivos. La quitina es un biopolímero abundante en el exoesqueleto de crustáceos y moluscos. El quitosano tiene propiedades fungicidas y capacidad para formar películas semipermeables. El objetivo de este trabajo fue evaluar el efecto de sales de lactato y acetato de quitosano en la calidad poscosecha del mango ‘Tommy Atkins’. Las frutas se sumergieron en las sales a 15 y 20 g L-1 durante cinco minutos y se conservaron a 14 ± 1 °C durante 12 días. Al final del almacenaje se determinó incidencia y severidad por antracnosis (%) y efectividad de los tratamientos, además pérdidas de masa fresca (%), SST (ºBrix), acidez titulable (%) y pH. La incidencia y severidad por antracnosis disminuyeron con las dos sales, la efectividad del acetato a 20 g L-1 fue 71,15 % en el control de la enfermedad. Las pérdidas de masa mostraron valores superiores a 5,53 % para las dos sales sin diferencias al control. Con lactato a las dos concentraciones hubo maduración normal de las frutas y con acetato el proceso fisiológico fue atrasado, evidenciado en los indicadores de madurez y la presencia de sabor extraño. Estos resultados demostraron las potencialidades de las sales de quitosano en el control de la antracnosis y calidad poscosecha del mango.
Palabras clave: antracnosis, biopolímero, Mangífera índica L., maduración.
ABSTRACT
Mango fruits have climacteric respiratory pattern and anthracnose disease affects their quality, so they have a short shelf life. Given the trends in fruit consumption without chemical residues, alternatives are sought to extend the post-harvest life, such as bioactive products. Chitin is an abundant biopolymer in the exoskeleton of crustaceans and mollusks. Chitosan have fungal properties and ability to form semi permeable films. The aim of this study was to evaluate the effect of chitosan lactate and acetate salts on post-harvest quality of mango ‘Tommy Atkins’. Fruits were submerged in chitosan salts at 15 and 20 g L-1and stored at 14 ± 1 °C for 12 days. At the storage end the incidence and severity were determined by anthracnose (%) and effectiveness of treatments, furthermore fresh mass loss (%), SST (°Brix), titratable acidity (%) and pH were determined. The incidence and severity of anthracnose decreased with the two salts, the acetate at 20 g L-1 exhibited 71,15 % effectiveness in disease control. The mass losses were greater than 5,53 % for the two salts without differences with the control. Lactate at two concentrations has a normal fruit ripening and with acetate, physiological process was delayed, evidenced in the maturity indicators and the presence of strange flavors.These results showed the potential of chitosan salts in the control of anthracnose and quality postharvest of fruits.
Key words: anthracnose, biopolymer, Mangifera indica L., ripening.
INTRODUCCIÓN
El quitosano es un polímero natural derivado del proceso de desacetilación de la quitina. La quitina es un biopolímero abundante en el exoesqueleto de crustáceos y moluscos, además forma parte de la estructura de la pared celular de ciertos hongos e insectos (1).
Una de las propiedades más importante del quitosano es su actividad antimicrobiana, varios estudios demuestran el efecto del bioproducto en el control de patógenos causantes de enfermedades fungosas en frutas (2,3).
Otra de las propiedades es la capacidad para formar películas semipermeables, la poca influencia en los indicadores de madurez y baja toxicidad para el ser humano. La aplicación como recubrimiento aporta buenos resultados en cuanto a reducción de pérdida de masa fresca y mejora de la calidad de las frutas, aunque están muy relacionados con el tipo de fruto, cultivar, condiciones de almacenaje, combinación con otros tratamientos poscosecha y la naturaleza, peso molecular y grado de desacetilación del quitosanoA(4).
Durante la comercialización de las frutas de mango (Mangifera indica L.) se producen elevadas pérdidas y una de las principales causas es la enfermedad conocida como antracnosis, ocasionada por el hongo Colletotrichum sp. (5). El control poscosecha se efectúa mediante métodos físicos (hidrotérmico) y químico o la combinación de ambos . La inmersión de frutas en agua caliente 50 a 55 ºC por cinco minutos (min.) y las aplicaciones de fungicidas como imazalil y procloraz son los más efectivos. Los fungicidas son aplicados de acuerdo a las exigencias del mercado (6-8).
Las frutas de mango son altamente perecederas y tienen una vida de anaquel corta. En este sentido se recomiendan diferentes tratamientos poscosecha que permitan la extensión del tiempo de almacenaje y reduzcan las pérdidas por esta causaB(9).
El cultivar de mango ′Tommy Atkins′ es originario de Florida, Estados Unidos de América. Actualmente figura entre los mejores cultivares de tipo rojo que se comercializa como fruta fresca en el mercado americano y europeo. En Cuba se introduce en la década de 1990 (10) y existe un gran interés en incrementar la comercialización de frutas hacia el mercado en fresco (frontera y exportación), pero las pérdidas poscosecha son elevadas, entre otras causas debido a problemas tecnológicos y alta incidencia de antracnosis (11).
Dadas las tendencias actuales del consumo de frutas sin residuos químicos, otras alternativas se buscan para el control de las enfermedades poscosecha y alargar la vida de anaquel, como es la aplicación de los productos bioactivos.
En Cuba, diferentes estudios demuestran las potencialidades del quitosano en la agricultura (12,13). Sin embargo, son escasos los relacionados sobre el uso del bioproducto para el control de enfermedades poscosecha y extensión de la vida de anaquel de frutas tropicales.
El objetivo de este trabajo fue evaluar el efecto de sales de lactato y acetato de quitosano en el control de la antracnosis y los indicadores de madurez de las frutas de mango ‘Tommy Atkins’.
MATERIALES Y MÉTODOS
Evaluación de sales de quitosano en el control de antracnosis y en los indicadores de madurez de las frutas de mango ‘Tommy Atkins’
Para el estudio se recolectaron frutas de mango ‘Tommy Atkins’ en estado de madurez fisiológica, de una plantación ubicada en la Unidad Científica Tecnológica de Base Alquízar, (UCTB, Alquízar), provincia Artemisa, que se encuentra en los 82°32´N y los 22°47´O, a 11 m sobre el nivel medio del mar, sobre un suelo Ferrasoléutrico con topografía llana de pendiente 0 (14).
Las sales de lactato y acetato quitosano 30 % (p/p) se aportaron por el Centro de Investigación y Desarrollo de Medicamentos (CIDEM) de Cuba.
El quitosano con grado de desacetilación 77,7 % y masa molar 310 000 g mol-1 se utilizó para la obtención de las dos sales por secado de pulverización y con las propiedades siguientes:
Lactato de quitosano masa molar 46,56 g mol-1 y pH 5,30.
Acetato de quitosano masa molar 48,86 g mol-1y pH 5,55.
Las frutas se lavaron con detergente Tropicleaner® 0,1%, se enjuagaron y se sometieron a la inmersión por cinco min. en:
Las frutas se conservaron a 14 ± 1°C, 80-85 % de humedad relativa (HR) durante 12 días y se determinó al final del almacenaje:
La incidencia por la antracnosis se estableció por el porcentaje de frutas afectadas, a partir del total de frutas evaluadas. Previamente se identificaron los síntomas por la enfermedad (15).
La severidad de los daños por la antracnosis se estableció a través del porcentaje del tejido lesionado del total de exocarpo de las frutas afectadas con una escala arbitraria de cinco grados, donde: Grado 0 (frutas sin daños), Grado 1 (frutas con 1-10 % con el exocarpo afectado), Grado 2 (frutas con 11-25 % con el exocarpo afectado), Grado 3 (frutas con 26-35 % el exocarpo afectado), Grado 4 (frutas con 36-50 % el exocarpo afectado). Se determinó la severidad en función del índice de infección (16) y la efectividad de los tratamientos (17).
Los siguientes indicadores de madurez fueron:
Masa fresca (g): con una balanza técnica Alsep modelo EZ- 5000 A (Error ± 0,01g) y la pérdida de masa fresca calculada por el porcentaje de pérdidas con respecto al peso inicial.
Firmeza del mesocarpo: con un texturómetro manual Lusa, modelo FT 40 (kgf), se introdujo un cilindro metálico de 6 mm de diámetro por cada lado del fruto y se obtuvo la firmeza promedio.
Sólidos solubles totales (SST) (° Brix): con un refractómetro COMECTA S.H FG-103 con corrección por temperatura para los datos correspondientes a 20 °C.
Acidez titulable: se tomaron alícuotas de 5 mL de extracto del mesocarpo y se valoraron con solución de hidróxido de sodio 0,1N. Se usó fenolftaleína como indicador. Los resultados se expresaron en porcentaje de ácido cítricos.
Por cada tratamiento se realizó un análisis sensorial, se utilizaron ocho panelistas, a quienes previamente se les explicó la escala hedónica de cuatro puntos relacionados con el gusto A: no me gusta, B: me gusta poco, C: me gusta D: me gusta mucho y el sabor a: Poco ácido, b: Acido, c: Muy ácido, d: Mal Sabor (fermentación o etanol).
Diseño experimental
Se empleó un diseño completamente aleatorizado.En cada evaluación de antracnosis se realizaron tres repeticiones (25 frutas x repetición) y los indicadores de madurez sobre 15 frutas de manera individual (15 repeticiones). El procesamiento estadístico de los resultados se realizó mediante un Anova de Clasificación Simple. Las medias se compararon por la Prueba de Tukey (p<0,05) (18). Se utilizó el programa estadístico STATISTICA Versión 6.0 (19).
RESULTADOS Y DISCUSIÓN
Evaluación de sales de quitosano en el control de antracnosis y en los indicadores de madurez
de las frutas de mango ′Tommy Atkins′
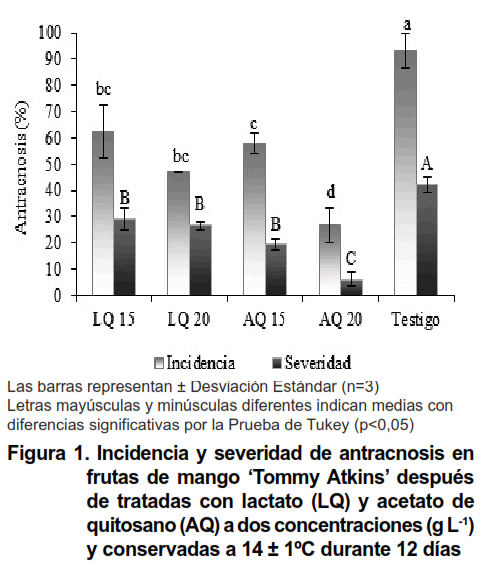
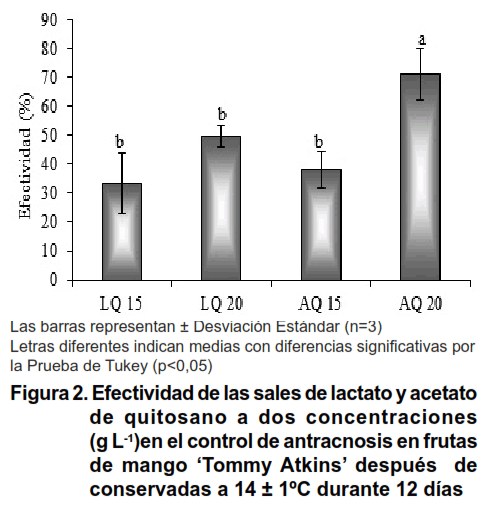
La inmersión de las frutas de mango en las dos sales de quitosano redujo significativamente la incidencia y severidad de antracnosis en comparación con el control (Figura 1). Con acetato 20 g L-1 hubo menor incidencia e índice de severidad, la efectividad fue superior al resto de los tratamientos (Figura 2). En frutas de mango previamente inoculadas con C. gloeosporioides y tratadas con quitosano a 0,5; 1,0; 1,5 y 2,0 % obtienen similares resultados (20). También en frutas de mango ‘Sanara’ con quitosano a 0,05; 0,1; 0,2 y 0,4 % encuentran menor incidencia por antracnosis y las concentraciones más bajas son menos efectivas (21).
Estudios in vitro indican la acción inhibitoria de distintos tipos y forma de aplicación de quitosano en el desarrollo del hongo Colletotrichum sp. aislado de varias especies de frutas con lesiones típicas de antracnosisC(22,23).
Resultados previos a este estudio muestran que la actividad antifúngica de las sales de lactato y acetato de quitosano sobre el Colletotrichum gloeosporioides (Penz.) Penz. & Sacc aislado de frutas de mango y papaya con antracnosis depende de la concentración utilizada y manifiesta la sensibilidad del hongo con sus diferentes etapas de desarrollo (24,25), por lo que la aplicación en frutas puede provocar un retraso en las etapas de infección, colonización de los tejidos y expresión de la enfermedad en el exocarpo.
La efectividad de las dos sales de quitosano en el control de antracnosis en las frutas puede deberse al pH de cada una de las sales, para lactato 5,30 y acetato 5,55. La actividad antimicrobiana del quitosano depende de factores como el pH, que ayuden acentuar la carga positiva de los grupos aminos en la cadena del biopolímero (26).
Otros mecanismos de acción del quitosano influyen en la actividad antimicrobiana, entre estos la carga positiva que exhibe el grupo amino en el carbono C2, que puede interactuar con las paredes celulares de los microorganismos cargadas negativamente y causar la desorganización celular y muerte de las células (27), así como el grado de desacetilación, polimerización y concentración (28,29) y el efecto en la activación de los mecanismos de defensa de las frutas (30). De igual manera, está dada por el tipo de microorganismo, estado físico del quitosano, factores ambientales, métodos complementarios de control y composición química del sustrato (31).
En la Tabla I se muestran los indicadores de madurez de las frutas después de tratadas con lactato y acetato de quitosano. La sal de acetato 15 g L-1 manifestó mayor valor de pérdida de masa que no diferenció de lactato 15 g L-1, así mismo no hubo diferencias entre lactato 15 g L-1, las dos sales a 20 g L-1 y el testigo. De manera general, las dos sales no presentaron un efecto en la reducción de las pérdidas de masa. Estos resultados no coinciden con los obtenidos en frutas de mango ‘Tommy Atkins’ con quitosano 1 % y conservadas a 14 ºC por 15 días, que muestran menor porcentaje de pérdidas de masa que las almacenadas a 20 ºC (32) y sí con lo que refieren otros autores, que el quitosano no reduce las pérdidas de masa fresca en frutas de mango ‘Ataulfo’, ‘Tommy Atkins’ y ‘Jinhwang’ (33-35).
En general, los recubrimientos comestibles a base de polisacáridos son una barrera poco efectiva para la humedad, debido a su naturaleza hidrofílica. Por este motivo, los recubrimientos destinados a frutas incorporan lípidos, plastificantes capaces de controlar la pérdida de peso de las frutas (36). Así mismo, la permeabilidad al vapor de agua de las películas de quitosano depende del grado de desacetilación y el peso molecular (37).
En este estudio no se observaron síntomas de deshidratación o marchitamiento en las frutas tratadas con lactato y acetato de quitosano. En frutas de naranja ‘Valencia’ encerada con FreshSealP® a base de quitosano a 2,5 % durante el almacenamiento refrigerado a 4 °C por ocho semanas más 6 días a 20 °C , tienen pérdidas de masa mayores y no manifiestan síntomas de deshidratación o marchitamiento. Este comportamiento en cuanto a las pérdidas de masa puede atribuirse a que las películas a base de quitosano poseen una mayor permeabilidad al vapor de agua que las cubiertas comestibles a base de carnauba, candelilla y otros polisácaridos (38).
El efecto positivo de la aplicación del quitosano en la disminución de las pérdidas de masa en diferentes frutas es resultado de la estructura densa de la película que actúa como barrera a los gases y reduce la tasa de respiración con la consecuente disminución del proceso de maduración (39,40).
La firmeza del mesocarpo de las frutas con acetato de quitosano a las dos concentraciones mostró valores significativamente mayores al control, a 15 g L-1 no hubo diferencias con la sal de lactato a las dos concentraciones. Las frutas tratadas con la sal de lactato presentaron menor firmeza sin diferencias al control. En frutas de mango ‘Bocado’ cuando utilizan entre otros recubrimientos el quitosano, obtienen mayor retención de la firmeza como resultado al retardo en la degradación de las protopectinas insolubles a pectinas solubles (41).
El quitosano crea una atmósfera modificada que reduce las alteraciones en los compuestos pécticos que forman la pared celular del hospedero, mantiene la firmeza de las frutas por más tiempo y reduce la vulnerabilidad al ataque de patógenos (42).
La efectividad de una película comestible o recubrimiento, también depende de las características del fruto (tipo de cutícula y velocidad de transpiración), de la producción de compuesto fenólicos, nutrientes naturales, composición química o nutricional de los sustratos y condiciones ambientales (43,44).
Las frutas con acetato de quitosano a las dos concentraciones presentaron valores menores de SST, alto contenido de ácidos titulables en correspondencia a pH bajo con diferencias significativas al control.Esto puede ser resultado a que el quitosano crea una barrera al O2, modifica la atmósfera interna, reduce el O2 y CO2, inhibiendo la respiración del fruto y como consecuencia se manifiesta un retraso en la maduración (45).
En las frutas con lactato, los SST fueron superiores, la acidez baja y pH alto sin diferencias al control, la aplicación de la sal de lactato no influyó en los indicadores de madurez que evolucionaron en correspondencia al período de frigoconservación y están muy relacionados con el sabor de las frutas, por lo que la maduración fue normal.
Las contradicciones encontradas en cuanto a los indicadores de calidad externas e internas de las frutas tratadas con dos sales y un solo quitosano, pueden estar dadas a las diferencias en las propiedades físicas y químicas de las dos sales, que dependen de la naturaleza del contraión. El contraión asociado al quitosano en su forma salina consigue apantallar en una extensión variable las cargas positivas de este, entre otras razones por efectos estéricos, así mismos la relación entre el pH de las diluciones de las sales y el pH natural del fruto (46,47). La aplicación de quitosano de mediano peso molecular disuelto en 0,5 % de ácido acético muestra los mejores resultados en el retardo de la maduración y extensión de la vida de anaquel de frutas de mango ‘Nam Dok Mai’ (48). Otros autores refieren que las frutas de mango sumergidas en quitosano tienen un proceso normal de maduración (32,33).
El análisis sensorial mostró que el mayor número de panelistas degustó en el grado de la escala C (me gusta) para las frutas con lactato de quitosano a las dos concentraciones y el control (Tabla II). Con acetato estuvieron en los grados A (no me gusta) y B (me gusta poco), también fueron catalogadas como frutas poco ácidas a 15 g L-1 y ácidas a 20 g L-1, a su vez presentaron mal sabor como a fermentado o etanol.
El método de aplicación, la concentración y el tiempo de inmersión de las frutas en la sal de acetato, que además se observó más densa y viscosa que el lactato, pudo impedir el intercambio de gases, afectar los procesos fisiológicos como la respiración y transpiración y provocar una alta concentración de compuestos volátiles como el etanol y acetaldehído, sustancias que se relacionan con la presencia de malos sabores. Similares criterios corroboran con el uso de quitosano a concentraciones superiores a 1,5 % en frutas de papaya (Carica papaya L.) (49).
Estos resultados son los primeros estudios sobre la aplicación de las sales de lactato y acetato de quitosano obtenidas por secado de pulverización, bajo las condiciones de producción del mango ‘Tommy Atkins’ en Cuba y muestran la aplicación práctica de estas en el proceso de acondicionamiento de las frutas para la comercialización, con efectos en los parámetros de calidad de las frutas similares a los encontrados cuando el quitosano se aplica en diluciones de ácidos acético y láctico.
La aplicación de las sales de quitosano en frutas de mango contribuirán al diseño de una nueva tecnología poscosecha, la cual permitirá la reducción de las pérdidas ocasionadas por antracnosis, alargar la vida de anaquel e incrementar la comercialización con calidad y sin residuos químicos, dada las tendencias actuales del consumo de frutas sanas e inocuas, siendo importante recomendar la sal de lactato de quitosano y continuar el estudio de otras formulaciones o combinaciones con otros compuestos orgánicos, inorgánico, biológicos y naturales, así como con diferentes tratamientos poscosecha para lograr mejores resultados en los parámetros de calidad.
CONCLUSIONES
Las sales de lactato y acetato de quitosano contribuyen a menor incidencia y severidad de los daños por antracnosis en frutas de mango ‘Tommy Atkins’, siendo la sal de acetato la de mayor efectividad en el control de la enfermedad.
Las sales de lactato y acetato de quitosano no favorecen la disminución de las pérdidas de masa en frutas de mango ‘Tommy Atkins’, la sal lactato de quitosano permite la maduración normal de las frutas y con acetato de quitosano se retrasa el proceso fisiológico, que se evidencia en los indicadores de madurez y por la presencia de malos sabores.
AGRADECIMIENTOS
Al personal del Grupo de Poscosecha del Instituto de Investigaciones en Fruticultura Tropical, por todo el apoyo, particularmente a los técnicos Adrián Paumier Jiménez y Juan González Vasallo y Especialista, Ingeniero Agrónomo Keny Espinosa Medina por su valiosa colaboración para la ejecución y culminación de esta investigación y al personal del Centro de Investigación y Desarrollo de Medicamentos (CIDEM) de Cuba por su contribución con las sales de quitosano, en especial a la investigadora Nilia de La Paz.
NOTAS AL PIE
AContrera A. Efecto de tratamientos poscosecha novedosos en la calidad fisicoquímica, sensorial y nutricional de cítricos [Internet] [Tesis de Doctorado]. [España]: Universidad Politécnica de Valencia; 2010 [cited 2016 Sep 6]. Available from: https://riunet.upv.es/bitstream/handle/10251/8986/tesisUPV3420.pdf
BBrecht J, Sargent S, Mitcham E, Maul F, Brencht P, Menocal O. Manual práctico para el mejoramiento poscosecha del mango [Internet]. Orlando, Florida: National Mango Board; 2014 [cited 2016 Sep 6]. 5-67 p. Available from: http://WWW. edis.ifas.ufl.edu/pdffiles/hs/hs119000.pdf
CCechim F. Quitosana na indução de resistência e controle in vitro de mofo cinzento, podridão parda e podridão amarga [Tese de Doutor]. [Brasil]: Universidade Tecnológica Federal do Paraná; 2014.
BIBLIOGRAFíA
1. Balanta D, Grande C, Zuluaga F. Extracción identificación y caracterización de quitosano del micelio de Aspergillium niger y sus aplicaciones como material bioadsorbente en el tratamiento de aguas. Revista Iberoamericana de Polímeros. 2010;11(5):297-316.
2. Canaver EB, Di Piero MR. Quitosana e adjuvantes para o controle preventivo do mofo azul da macieira. Tropical Plant Pathology. 2011;36(6):419-23.
3. Bautista-Baño S, Sivakumar D, Bello-Pérez A, Villanueva-Arce R, Hernández-López M. A review of the management alternatives for controlling fungi on papaya fruit during the postharvest supply chain. Crop Protection. 2013;49:8-20. doi: 10.1016/j.cropro.2013.02.011.
4. Jianglian S, Shaoying Z. Application of Chitosan Based Coating in Fruit and Vegetable Preservation: A Review. Journal Food Process Technology. 2013;4:227. doi: 10.4172/2157-7110.1000606.
5. Kamle M, Kumar P, Gupta V, Tiwari A, Misra A, Pandey B. Identification and phylogenetic correlation among Colletotrichum gloeosporioides pathogen of anthracnose for mango. Biocatalysis and Agricultural Biotechnology. 2013;2:285–7. doi: 10.1016/j.bcab.2013.02.001.
6. Kumah P, Appiah F, Opoku-Debrah J. Effect of hot water treatment on quality and shelf-life of Keitt mango. Agriculture and Bioogical Journal North American. 2011;2(5):806-17. doi: 10.5251/abjna.2011.2.5.806.817.
7. Mulkay VT, Paumier JA, Alonso MO, González VJ, Aranguren GM, Díaz BC, García CM, Jiménez VR. Tecnología poscosecha del mango (Mangifera indica L.) para el mercado de frutas frescas en Cuba. CitriFrut. 2014;31(1):56-60.
8. Sripong K, Jitareerat P, Uthairatanakij A, Varit- Srilaong A, Wongs-Aree Ch, Tsuyumu S, Kato M. Effects of hot water UV-C and modified coconut oil treatments on suppression of anthracnose disease and maintenance of quality in harvested mango cv. “Chok-Anan”. Journal of Food and Nutrition Sciences. 2015;3(1-2):1-8. doi: 10.11648/j.jfns.s.2015030102.22.
9. Corona MC, Mercado SE, Vázquez BE, Palma IML. Aplicación de la irradiación gamma como tratamiento cuarentenario y sus efectos sobre la calidad y microestructura de mango cv. “Ataulfo” In: IV Simposio Internacional de Fruticultura Tropical y Subtropical. Mayabeque, Cuba; 2013. p. 5.
10. Ministerio de la Agricultura. Catálogo de cultivares de mango en Cuba. La Habana, Cuba; 2014. 123 p.
11. Alonso MS, Mulkay VT, González VJ, Paumier JA, González LI, Reyes RN, Díaz BC, García CM. Optimización de la tecnología de acondicionamiento para los frutos de mango (Mangifera indica L.) cv. “Tommy Atkins” en Jagüey Grande. CitriFrut. 2014;31(2):30-34.
12. Torres HL, Rodríguez IL, Miñoso DJ, Pino HY, Zamora IJ. Efecto de diferentes momentos de aplicación de quitosana en la respuesta productiva de la papa (Solanum tuberosum L.) variedad Call White. In: XVIII Congreso Científico del Instituto Nacional de Ciencias Agrícola. Mayabeque, Cuba: INCA; 2012. p.149.
13. Rosabal AL, Reyes GY, Martínez GL, Dell-Amico RJ, Núñez VM. Efecto de la quitosana en la germinación y el crecimiento inicial de plántulas de frijol (Phaseolus vulgaris L.) sometidas a déficit hídrico. In: XVIII Congreso Científico del Instituto Nacional de Ciencias Agrícola. Mayabeque, Cuba: INCA; 2012 p.151.
14. Hernández JA, Pérez JM, Bosch D, Rivero L, Camacho E, Ruíz J, et al. Nueva versión de clasificación genética de los suelos de Cuba. La Habana, Cuba: AGROINFOR; 1999. 64 p.
15. Ploetz RC, Zentmyer GA, Nishijima WT, Rohrbach KG, Ohr HD. Compendium of tropical fruit diseases [Internet]. Vol. 8. American Phytopathological Society (APS); 1994 [cited 2016 May 30]. 88 p. Available from: http://www.cabdirect.org/abstracts/19942309422.html
16. McKinney HH. Influence of soil temperature and moisture on infection of wheat seedlings by Helmintosporium sativum. Journal. Agric. Res. 1923;26:195-218.
17. Abbott WS. A method of compoting the effectiveness of on insecticide. Journal Economic Entomology. 1925;181:267. doi: 10.1093/jee/18.2.265ª.
18. Tukey JW. Bias and confidence in not quite large samples. The Annals of Mathematical Statistics. 1958;29(2):614–23.
19. StatSoft. STATISTICA (data analysis software system) [Internet]. Version 6. US: StatSoft, Inc.; 2001. Available from: http://www.statsoft.com
20. Pongphen J, Sudkanueng PY, Sirichai K. Effect of chitosan on ripening enzymatic activity and disease development in mango (Magifera indica L.) fruit, New Zealand. Journal of Crop and Horticultural Science. 2007;35:211-18.
21. Abd-AllA M, Wafaa M. New Safe Methods for Controlling Anthracnose Disease of Mango (Mangifera indica L.) Fruits Caused by Colletotrichum gloeosporioides (Penz.). Journal of American Science. 2010;8(8):361-67. doi: 10.7537/marsjas061010.10.
22. Zahid N, Ali A, Manickam S, Siddiqui Y, Maqbool M. Potential of chitosan loaded nanoemulsions to control different Colletotrichum spp. and maintain quality of tropical fruits during cold storage. Appl. Microbiol. 2012;113:925–39. doi: 10.1111/j.1365-2672.2012.05398.
23. Ali A, Zahid N, Sivakumar M, Siddiqui Y, Alderson P, Maqbool M. Effectiveness of submicron chitosan dispersions in controlling anthracnose and maintaining quality of dragon fruit. Postharvest Biol. Technol. 2013;86:147–53. doi: 10.1016/j.postharvbio.2013.06.027.
24. González LI, Mulkay VT, Paumier JA. Actividad antifúngica de sales de quitosana sobre patógenos causantes de enfermedades poscosecha en papaya (Carica papaya L.). Fitosanidad. 2014;18(1):33-44.
25. Mulkay VT, Paumier JA, González VJ, González LM. Efecto de sales de quitosana sobre Colletotrichum gloeosporioides (Penz.) Penz. & Sacc. aislado de la antracnosis del mango. CitriFrut. 2016;33(1):46-51.
26. Ramírez M, Rodríguez AT, Alfonso L, Peniche C. La Quitina y sus derivados bipolímeros con potencialidades de aplicación agrícola. Biotecnología Aplicada. 2010;27:262-9.
27. Goy RC, Britto D, Assis O. A review of the antimicrobial activity of chitosan. Polímeros. 2009;19(3):241-7. doi: 10.1590/S0104-14282009000300013.
28. Kong M, Chen X, Xing K, Park H. Antimicrobial properties of chitosan and mode of action: A state of the art review. International Journal of Food Microbiology. 2010;14(1):51-63. doi: 10.1016/j.ijfoodmicro.2010.09.012.
29. Benhabiles M, Salah R, Lounici H, Drouiche N, Goosen M, Mameri N. Antibacterial activity of chitin chitosan and its oligomers prepared from shrimp shell waste. Food Hydrocolloids. 2012;29(1):48-56. doi: 10.1016/j.foodhyd.2012.02.013.
30. Dutta PK, Tripathi S, Mehrotra GK, Dutta J. Perspectives for chitosan based antimicrobial films in food applications. Food Chemistry. 2009;114(4):1173-82. doi: 10.1016/j.foodchem.2008.11.003.
31. El-Eleryan E. Effect of chitosan and green tea on the quality of Washington Navel orange during cold storage. American Journal Plant Physiology. 2015;10(1):43-54. doi: 10.3923/ajpp.2015.43.54.
32. López ML, Gutiérrez MP , Bautista BS, Jiménez GL, Zavaleta MH. Evaluación de la actividad antifúngica del quitosano en Alternaria alternata y en la calidad del mango “Tommy Atkins” durante el almacenamiento. Rev. Chapingo. Serie Horticultura. 2013;19(3):315-31. doi: 10.5154/r.rches.2012.07.038.
33. Muy RD, Espinoza VB, Siller CJ, Sañudo BA, Valdez TB, Osuna ET. Efecto del 1 Metilciclopropeno (1MCP) y de una película comestible sobre la actividad enzimática y calidad poscosecha del mango “Ataulfo”. Rev. Fitotecnia Mexicana. 2009;32(1):53-60.
34. de Souza LM, Ascari MC, Magalhães MK, Machado MC, Mattiuz BH. Pós-colheita de mangas “Tommy Atkins” recobertas com quitosana. Rev. Bras. Frutic Jaboticabal. 2011; Suppl.:337-43. doi: 10.1590/S0100-29452011000500042.
35. Wongmentha O, Ke L. The Quality Maintenance and Extending Storage Life of mango Fruits after Postharvest Treatments. World Academic of Science Engineering and Technology. 2012;6(9):844-9.
36. Sandoval C, Jacomino A, Fumi F, Carraro A. Recobrimento de goiabas com films proteicos e de quiosana. Bragantia Campinas. 2011;70(1):216-21. doi: 10.1590/S0006-87052011000100001.
37. Santos C, Seabra B, Veleirinho I, Delgadillo J Lopes da Silva J. Acetylation and molecular mass effects on barrier and mechanical properties of short fins quid. European Polymer J. 2006;42(12):3277-85. doi: 10.1016/j.eurpolymj.2012.11.009.
38. Fortiz HJ, Mercado RJ, Rodríguez FA. Efecto de recubrimiento con Quitosano y cera comercial en la calidad de naranja “valencia” durante el almacenamiento. Rev. Iberoamericana de Tecnología Postcosecha. 2011;12(2):164-74.
39. Bal B. Postharvest Application of Chitosan and Low Temperature Storage Affect Respiration Rate and Quality of Plum Fruits. J. Agr. Sci. Tech. 2013;15:1219-30.
40. Plainsirichaia M. Leelaphatthanapanicha S, Wongsachaia N. Effect of Chitosan on the Quality of Rose Apples (Syzygium agueum Alston) cv. Tabtim Chan Stored at an Ambient Temperature. APCBEE Procedia.2014;8:317-22. doi: 10.1016/j.apcbee.2014.03.047.
41. Valera A, Materano W, Maffei M, Quintero I, Zambrano J. Uso de recubrimientos comestibles y baja temperatura para mantener la calidad de frutos de mango ‘Bocado’ durante el almacenamiento. Revista de la Facultad de Agronomía (LUZ). 2011;28(Suppl.1):600-8.
42. Cia P, Aparecida BE, Florentino PS, Oliveira GE. Quitosana no controle pós-colheita da podridão mole em caqui “rama forte”. Bragantia Campinas. 2010;69(3):745-52. doi: 10.1590/S0006-87052010000300028.
43. Becerra JJ, Valdivia UB, Aguilar NC, Martínez HJ, Contreras EJ, Cuellar LC. Quitosan Fúngico: Fuentes y Propiedades. Acta Química Mexicana. 2011;3(5):24-32.
44. Contreras-Oliva A, Pérez-Gago B, Salvador A, Bermejo A, Rojas-Argudo C. Calidad fisicoquímica sensorial y nutricional de naranjas cv. Valencia recubiertas con quitosano. Agrociencia. 2012;46(5):441-53.
45. Bal L. Postharvest application of chitosan and low temperature storage affect repiration rate and quality of plum fruits. J. Agr. Sci. Tech. 2013;15:1219-30.
46. Lárez VC. Algunas potencialidades de la quitina y el quitosano para usos relacionados con la agricultura en Latinoamérica. Revista Científica UDO Agrícola. 2008;8(1):1-22.
47. de la Paz N, García C, Fernández M, García L, Martínez V, López O, Nogueira A. Estabilidad de las sales de quitosana obtenidas por secado de aspersión derivadas de quitina de langosta . Ars Pharm. 2015;56(4):217-24. doi:org/10.4321/S2340-98942015000400005.
48. Ampaichaichok P, Rojsitthisak P, Seraypheap K. Effects of different molecular weights of chitosan coatings on postharvest qualities of “Nam Dok Mai” mango. In: II International Conference on Food and Agricultural Sciences [Internet]. IPCBEE; 2014 [cited 2017 Apr 15]. p. 16–20. Available from: http://www.ipcbee.com/vol77/004-ICFAS2014-F0007.pdf
49. Asgar A, Muhammad TM, Kamaruzaman S, Yasmeen S. Potential of chitosan coating in delaying the postharvest anthracnose Colletotrichum gloeosporioides Penz. of Eksotika II papaya. Int. J. Food Sci. Technol. 2010;45:2134–40. doi: 10.1111/j.13652621.2010.02389.x
Recibido: 28/09/2016
Aceptado: 27/01/2017
M.Cs. Tania Mulkay-Vitón, Instituto de Investigaciones en Fruticultura Tropical. Ave 7ma No. 3005 e/ 30 y 32. Playa, CP 11300, Cuba. Email: poscosecha@iift.cu