
Aislamiento
y selección de bacterias autóctonas de manabí-ecuador con actividad celulolítica
Isolation
and selection of autochthonous bacteria from Manabí-Ecuador with cellulolytic
activity
Ms.C. Ángel M. Guzmán Cedeño,I,II Diego E. Zambrano Pazmiño,I Ruben D. Rivera Fernández,I Ana J. Rondón,III Ms.C. Marta Laurencio Silva,III Manuel Pérez QuintanaIII
IEscuela
Superior Politécnica Agropecuaria de Manabí "Manuel Félix López",
10 de agosto no. 82 y Granda Centeno. Calceta. Manabí, Ecuador.
IIUniversidad Laica "Eloy Alfaro" de Manabí. Ciudadela
Universitaria Vía San Mateo. Manta. Manabí, Ecuador.
IIIUniversidad de Matanzas "Camilo Cienfuegos"
Apartado Postal 44740, km 3 ½, Matanzas, Varadero, Cuba.
RESUMEN
La presente investigación tuvo como objetivo aislar y seleccionar bacterias con capacidad celulolítica, que tengan aplicación futura como inóculo en el compostaje de residuos orgánicos fibrosos. Se consideraron cinco ambientes de muestreo: agricultura orgánica (AO); agricultura convencional (AQ); bosque (BM); área cañera (RC) y pilas de compost (AC). Para el aislamiento se usó el medio agar nutriente modificando la fuente de carbono por celulosa. El criterio principal de selección de los aislamientos bacterianos fue el crecimiento sobre el medio antes mencionado y su reacción positiva frente a la prueba de rojo congo, observándose zonas claras alrededor de las colonias. Se obtuvo 93 aislamientos bacterianos a los que se les realizó tinción de Gram, prueba de catalasa; se observó presencia de endosporas y crecimiento en aerobiosis; presentando 70 bacterias características similares a Bacillus spp. A las mismas se le determinó actividad celulolítica y se encontró que 30 bacterias produjeron halo de hidrólisis. De ellas se seleccionaron los ocho aislamientos bacterianos que produjeron el mayor halo (AO-19; AO-28; AO-29; AQ-2; BM-7; RC-2; RC-6; RC-18) y se les evaluó su crecimiento a diferentes pH (3, 5, 7, 9) y temperaturas (50 y 70 ºC). La bacteria AO-19 mostró mayor halo de hidrólisis con 12,33 mm y estabilidad de crecimiento en los diferentes niveles de pH y temperatura estudiados; por lo cual se determinó su dinámica de crecimiento y capacidad amilolítica y pectinolítica. De acuerdo a los resultados la bacteria AO-19 posee potencial para ser usada como inóculo en la elaboración de compost.
Palabras clave: Bacillus, inóculo bacteriano, compostaje, plasticidad ecológica.
ABSTRACT
The present study aimed to isolate and select bacteria with cellulolytic capacity, having future application as inoculum in the fibrous organic waste composting. Five sampling environments were considered: organic agriculture (AO), conventional agriculture (AQ), forest (BM); sugarcane area (RC) and compost piles (AC). For bacterial isolation the nutrient agar medium was used changing the carbon source by cellulose. The main selection criterion of the bacterial isolates was the growth on above medium and its positive reaction to congo red test, showing clear zones around the colonies. The 93 bacterial isolates obtained were subjected to Gram staining, catalase test, presence of endospores and aerobically growth; having 70 bacteria Bacillus spp. like characteristics. Their cellulolytic activities were determined and 30 bacteria produced hydrolysis halo. Eight of these bacterial isolates were selected according to the largest halo production (AO-19, AO-28, AO-29, AQ-2, BM-7, RC-2, RC-6, CR-18) and their growth at different pH (3, 5, 7, 9) and temperatures (50 and 70 °C) were evaluated. The bacteria AO-19 showed higher hydrolysis halo with 12,33 mm and growth stability at different pH and temperature levels, for which its growth dynamic and amylolytic and pectinolytic capacity was determined. According to results the bacteria AO-19 has potential to be used as inoculum in composting.
Key words: Bacillus, bacterial inoculum, composting, ecological plasticity.
INTRODUCCIÓN
La disposición
final de los residuos orgánicos generados en el mundo representa un problema
que afecta al medio ambiente. En los momentos actuales se busca reducir la masa
de tales residuos de origen agropecuario, agroindustrial y de botaderos municipales,
mediante la implementación de métodos biotecnológicos que contribuyan a disminuir
su volumen y a favorecer su reutilización como abono para mejorar las características
física, química y biológica de los suelos con aptitud agrícola (1, 2).
Entre las opciones de manejo está el compostaje, que es un proceso bio-oxidativo,
que exige un condicionante biológico para su funcionamiento y, por tanto, estará
afectado por factores muy diversos, que influirán en mayor o menor grado en
la optimización de la actividad microbiana. El proceso implica sustratos orgánicos
heterogéneos en su composición y homogéneos en su tamaño. Durante la transformación
se suceden diferentes etapas, que concluyen en reacciones de diferente significado,
con producción de metabolitos intermedios que pueden resultar fitotóxicos, de
ahí la importancia del control de la maduración. Finalmente, el proceso de compostaje
conduce a la liberación de CO2, agua, minerales y materia orgánica (MO) más
o menos estabilizada, rica en poblaciones microbianas útiles y en bioactivadores
de la fisiología vegetal (3, 4, 5).
En los suelos, la diversidad biológica funciona como reciclador de la materia
orgánica, tanto en la dinámica de circulación de nutrientes como en los flujos
de energía (6, 7). Sin embargo, no todos los microorganismos presentes pueden
producir las enzimas extracelulares requeridas para la degradación, sobre todo
de los materiales fibrosos, que a su vez no sean afectados por factores físicos
y químicos durante el proceso de hidrólisis, lo cual incide en los tiempos requeridos
para la humificación y mineralización de los materiales biodegradados hasta
convertirse en compuestos más simples para ser absorbidos por las plantas (3,
4).
El mecanismo ampliamente aceptado para explicar la hidrólisis enzimática de
la celulosa y hemicelulosa, componentes principales de las paredes vegetales
(8), involucra la acción conjunta de un consorcio de enzimas microbianas, de
las cuales la ß-1,4 endo-glucanasa (endo-(1?? 4)-B-D-glucanohidrolasa), la ß-1,4
exo-celobiohidrolasa y la ß-1,4 glucosidasa son las más importantes (9, 10).
Sin embargo, las actividades hidrolíticas son afectadas por una serie de factores
físicos y químicos que limitan la degradación de la celulosa insoluble (11,
12); es por ello, que la búsqueda de microorganismos con mejores capacidades
celulolíticas, pondría a disposición nuevas fuentes biológicas con actividad
celulasa y, por tanto, con posibilidad de ser empleadas en el tratamiento de
residuos orgánicos vegetales para producir compost.
Los microorganismos degradadores de celulosa incluyen hongos y bacterias, aerobios
y anaerobios, mesófilos y termófilos, que ocupan una variedad de hábitats. Los
suelos son considerados los ambientes más diversos desde el punto de vista microbiano
en la Tierra, debido a su gran heterogeneidad física, química y biológica. Por
ejemplo, se pueden encontrar hasta 109 bacterias en un gramo de suelo del horizonte
A, con una diversidad de más de 4 600 genomas distintos, ya que la abundancia,
composición y la diversidad de las comunidades microbianas en el suelo están
fuertemente relacionadas con el nivel de profundidad (13).
Entre las bacterias celulolíticas se destacan las de los géneros Cellulosomas
sp, Pseudomonas sp., Cytophaga sp. y Bacillus sp. (14, 15). Indudablemente los
organismos autóctonos tienen ventaja sobre los introducidos en que su acción
es más efectiva, ya que no necesitan adaptarse a las condiciones de clima, humedad
y poblaciones de microorganismos que se encuentran en la zona donde se les utiliza
(9, 10).
En Ecuador, y particularmente en Manabí, se ofertan inóculos importados como
aceleradores del proceso de compostaje. Sin embargo, no se informa en la etiqueta
la procedencia e identificación, a nivel de especie, de esos microorganismos
y, por tanto, no es posible referir con especificidad el resultado de su uso
(16). El objetivo de esta investigación fue aislar, seleccionar y caracterizar
bacterias autóctonas, de esta localidad, con actividad celulolítica que tengan
potencial para la obtención de bioproductos a ser empleados como inóculos en
la producción de compost de calidad.
MATERIALES Y MÉTODOS
Recolección
de muestras de suelo
Esta actividad se desarrolló en una amplia zona de vida Tropical Subhúmeda en
la provincia de Manabí-Ecuador, que registra una temperatura promedio de 28
°C y alrededor de 800 mm de precipitación anual, repartida en un periodo lluvioso
de seis meses (diciembre-mayo).
Los ambientes de muestreo fueron: 1) área de agricultura orgánica (AO)-dedicada
a la práctica agroecológica de policultivos hortícolas, incorporación constante
de material orgánico al suelo, fresco o estabilizado, y un valor de alrededor
del 4,06 % de MO; 2) área de agricultura convencional (AQ)-en la que se realizan
cultivos intensivos de ciclo corto, empleando prácticas agronómicas químico-mecanizadas,
posee suelo de topografía plana, buen drenaje y 1,37 % de MO; 3) bosque artificial
(BM)-conformado principalmente por las especies madereras: caoba, guachapelí
y roble, de aproximadamente 20 años de edad, que ha generado una capa de hojarasca
en el suelo de unos cinco centímetros; tiene asociado vegetación espontánea,
gramíneas de porte bajo y dicotiledóneas tolerantes a la sombra, el suelo contiene
4,05 % de MO. Estos tres ambientes sirven de práctica estudiantil y pertenecen
al campus politécnico de la Escuela Superior Politécnica Agropecuaria de Manabí
"Manuel Félix López" (ESPAM-MFL), ubicada en el cantón Bolívar.
Los otros ambientes son: 4) área de producción de caña de azúcar (RC)-de aproximadamente
10 años de explotación en monocultivo, tiene una evidente acumulación de residuos
fibrosos, alta retención de humedad y 1,61 % de MO en el suelo; el lugar pertenece
al cantón Chone; 5) unidad de producción de compost (AC)-ambiente bajo cubierta
y piso de cemento donde se composta grandes volúmenes de residuos orgánicos
empleando maquinaria en la remoción y volteos de los materiales, el sistema
de compostaje es abierto y existen pilas en diferentes etapas del proceso, la
seleccionada para el muestreo tenía ocho semanas de duración y 25,51 % de MO;
esta infraestructura pertenece a la bananera orgánica "Nueva Esperanza"
ubicada en el cantón Tosagua.
De cada ambiente se extrajo una muestra compuesta de 500 g, a partir de tres
sitios de muestreo a 10 cm de profundidad, escogidos por el hábitat favorable
al nicho ecológico de los microorganismos celulolíticos (15, 17).
Aislamiento y selección preliminar de las bacterias de los diferentes
ambientes
Las muestras fueron procesadas en el Laboratorio de Biología Molecular de la
ESPAM "MFL". Para el aislamiento se tomó 1 g de sustrato de las muestras
colectadas en cada uno de los ambientes y se siguió la metodología de las diluciones
seriadas (18). Se utilizó el medio agar nutriente modificado (19) que contenía
peptona 0,6 %, extracto de levadura 0,2 %, cloruro de sodio 0,5 %, celulosa
amorfa (Himedia) 1,5 % y agar 1,5 %. El pH fue ajustado a 7,3. Se hicieron diluciones
(1:10) hasta 10-6 y se sembraron por triplicado las diluciones, desde 10-4 hasta
10-6. Posteriormente, se incubaron por 24 horas a 37±2 °C. Se seleccionaron
todas las colonias con características morfológicas diferentes y se sembraron
en tubos con agar nutriente para su conservación y posterior uso.
A todas las bacterias aisladas se les realizó la tinción de Gram, prueba de
la catalasa, crecimiento en aerobiosis (20) y tinción de endosporas (21). Se
seleccionaron aquellas que resultaron bacilos Gram positivos, con presencia
de endosporas, catalasa positiva y crecieron en condiciones de aerobiosis.
Determinación cualitativa de la capacidad celulolítica
Los aislamientos bacterianos seleccionados se inocularon en punción en placas
con agar nutriente suplementado con Carboximetilcelulosa (CMC), 1 % (p/v). Dicho
medio estaba compuesto por CMC 1,0 %, extracto de levadura 0,25 %, peptona 0,25
%, sulfato de amonio 0,05 %, cloruro de calcio 0,05 %, fosfato monobásico de
potasio 0,01 %, fosfato dibásico de potasio 0,01 % y agar 1,5 %; el pH del medio
fue ajustado a 7,0 y se incubó a 37 °C por 72 horas. Culminado el tiempo de
incubación se reveló la degradación de CMC cubriendo el medio con solución de
rojo congo 1,0 % (p/v). El colorante se dejó actuar por 15 minutos, se retiró
el exceso y se lavó dos veces con solución de cloruro de sodio 2 mol L-1,
dejando en reposo durante 15 minutos. Transcurrido este tiempo se determinó
la actividad celulolítica por la presencia de zonas claras (halos) manifestado
por la hidrólisis de la celulosa, cuyo diámetro fue medido en milímetros (22,
23).
Capacidad de crecimiento de los aislamientos bacterianos degradadores de CMC
Para evaluar la capacidad de crecimiento, se refrescaron los aislamientos bacterianos,
inoculando una azada de cada muestra en 25 mL de caldo nutriente, este medio
estaba compuesto de peptona 1,0 %, extracto de levadura 1,0 %, cloruro de sodio
0,5 %, ajustado el pH a 7,3. Se incubó por 24 horas a una temperatura de 37
°C; de esta suspensión se tomaron 5 mL que se adicionaron a 50 mL de caldo nutriente,
de donde se extrajo una muestra para evaluar en el espectrofotómetro (Jenway
6305) la densidad óptica a una longitud de onda de 660 nm, a las 24 horas.
Capacidad de crecimiento a distintos valores de pH y temperatura de los aislamientos
bacterianos con capacidad celulolítica
Se seleccionaron las bacterias que produjeron el mayor halo de hidrólisis de
celulosa, como criterio primario de selección, y se evaluó la dinámica de crecimiento
a diferentes pH y temperaturas:
pH
Las bacterias seleccionadas se cultivaron en caldo nutriente con pH 7,3, se
incubaron a 37 ºC por 18 horas y una agitación de 130 rpm en la zaranda (24).
De cada cultivo se tomó 5 mL con 1010 UFC mL-1 y se inoculó en erlenmeyers
de 125 mL de capacidad efectiva y 45 mL de caldo nutriente. El pH del medio
en los erlenmeyers fue ajustado previamente a 3-5-7-9 con HCl 0,1 N (25).
Todas las muestras fueron incubadas a 37 ºC por 24 horas. Simultáneamente, se
conformó el control en caldo nutriente a pH 7,3 bajo las mismas condiciones
de los tratamientos. Se realizaron tres repeticiones por cultivo.
En el momento de la inoculación, a las horas cero y 24, se realizó el conteo
de células viables mediante diluciones seriadas en solución salina estéril,
se sembraron por triplicado las diluciones entre 10-9 y 10-11 en placas con
agar nutriente. Se realizó la incubación a 37 ºC por 24 horas. El porcentaje
de sobrevivencia se calculó por la ecuación de Kociubinski
(26).

Se repitió la misma
fórmula para cada uno de los pH estudiados. Se tomó como criterio de selección
un porcentaje de crecimiento de las bacterias mayor o igual al 50 %, a las 24
horas de incubación.
Temperatura
Los aislamientos bacterianos se cultivaron en caldo nutriente con pH 7,3 e incubaron
a 37 ºC por 18 horas, en condiciones de zaranda a 130 rpm de agitación (23).
De cada cultivo se tomaron 5 mL con 1010 UFC mL y se inocularon en erlenmeyer
de 125 mL de capacidad efectiva con 45 mL de caldo nutriente pH 7,3 y se incubaron
a 50 y 70 ºC por 24 horas. Posteriormente, se realizó el conteo de células viables
mediante la técnica de las diluciones seriadas (18) en solución salina estéril,
se sembraron por triplicado las diluciones entre 10-9 hasta 10-11
en placas con agar nutriente.
Caracterización
de la bacteria seleccionada
Al aislamiento bacteriano que resultó con mejores valores en los parámetros
anteriormente descritos se le realizó la siguiente caracterización:
Crecimiento
Se realizó una dinámica de crecimiento a las horas 0, 4, 8, 12, 16, 20 y 24,
a partir de cultivo fresco en cuñas de agar nutriente que se inoculó en caldo
nutriente (1:10) en erlenmeyers de 100 mL de capacidad que contenían 50 mL de
medio, los mismos se incubaron en zaranda termostatada a 37 ºC y 130 rpm de
agitación (24). En los tiempos indicados se retiraron los erlenmeyers para realizar
el conteo de células viables mediante la técnica de las diluciones seriadas
en solución salina estéril, se sembraron por triplicado las diluciones entre
10-9 y 10-11 en placas con agar nutriente. Se realizó
la incubación a 37 ºC por 24 horas.
Actividad
amilolitica y pectinolítica
Para la determinación de la actividad amilolitica, la bacteria seleccionada
se inoculó en placas con agar nutriente-almidón al 1,0 % (p/v) (27). Este medio
de cultivo se modificó con una composición a base de almidón soluble 1,0 %,
extracto de levadura 0,25 %, peptona 0,25 %, sulfato de amonio 0,05 %, cloruro
de calcio 0,05 %, fosfato monobásico de potasio 0,01 %, fosfato dibásico de
potasio 0,01 % y agar 1,5 %. El pH se ajustó a 7,0 y se incubó a 37 ºC por 72
horas. La degradación se reveló utilizando una solución de lugol al 0,50 % (p/v),
durante dos minutos, hasta cubrir el medio para una mejor observación del halo
de digestión. Como control negativo se utilizó una placa de agar nutriente con
almidón al 0,2 % (p/v) sin inocular y como control positivo de degradación se
utilizó una cepa de Bacillus cereus ATCC-14579 (28, 29).
Para la determinación de la actividad pectinolítica, la cepa seleccionada se
inoculó en agar pectina al 1,0 % (p/v) (27). Este medio de cultivo se modificó
con una composición a base de pectina soluble 1,0 %, sulfato de amonio 0,05
%, cloruro de calcio 0,05 %, fosfato monobásico de potasio 0,01 %, fosfato dibásico
de potasio 0,01 % y agar 1,50 %. El pH se ajustó a 7,0 y se incubó a 37 ºC por
72 horas. La actividad pectinolítica se determinó por la presencia de zonas
de aclaramiento alrededor de las colonias, a causa de la hidrólisis de la pectina,
revelado con lugol; como control positivo de degradación se utilizó una cepa
de Bacillus cereus ATCC-14579 (28, 29).
Análisis estadístico
Para el análisis de los datos se utilizó el sistema INFOSTAT Versión 1 (30).
Los análisis de varianza se realizaron para determinar diferencias significativas
entre las variantes. La prueba de Tukey se usó para realizar las comparaciones
múltiples entre las medias. Los conteos de microorganismos viables se transformaron
a Log N, para garantizar las condiciones de normalidad en la curva de crecimiento.
Para el análisis, se aplicó la fórmula (K+N)*10x, donde K es la constante que
representa el logaritmo de la dilución en la cual se inoculó el microorganismo;
N es el logaritmo del número de UFC determinado y x es la dilución a la cual
se efectuó la inoculación. Cuando el conteo fue igual a cero se sumó una constante
(x + 0,375).
RESULTADOS
Y DISCUSIÓN
Aislamiento y selección preliminar de las bacterias de los diferentes
ambientes
Se aislaron un total de 93 bacterias (Tabla
I). En cuanto al sitio de muestreo el área cañera (RC) resultó ser un buen
hábitat para las bacterias de interés, probablemente porque el depósito de residuos
fibrosos favorece la presencia de microorganismos con capacidad celulolítica.
En tal sentido, se menciona que es indispensable considerar el tipo de muestra
y zonas de muestreos, como una condición importante para lograr aislar bacterias
con altas posibilidades degradativas de residuos celulolíticos (31).

Del área orgánica (AO) se obtuvo el segundo mejor porcentaje de aislamientos
bacterianos, lo cual podría ser favorecido por la incorporación de abonos orgánicos
y prácticas de conservación que se realizan como parte del manejo ecológico
del suelo (6, 7). Un comportamiento similar se observó en el ambiente bosque
(BM), donde se obtuvo un número considerable de aislamientos bacterianos. Este
resultado guarda relación con el alto número de bacterias reportadas en estudios
de dinámica poblacional llevados a cabo en suelos de áreas boscosas tropicales,
con elevado contenido de materia orgánica fibrosa en diferentes grados de descomposición
(15, 16, 32).
En el área convencional (AQ) se obtuvo el menor número de aislamientos bacterianos,
posiblemente las labores químico-mecanizadas que se están realizando al suelo
influyan en el bajo nivel de materia orgánica y, por ende, en la dinámica poblacional
de los microorganismos descomponedores (33, 34).
Igualmente, en el compost (AC) se encontró un número de aislamientos bacterianos
similar al área convencional, a pesar del alto contenido en materia orgánica
del compost. Lo cual se pudiera explicar porque la muestra de compost tomada
parece ser de una pila en fase avanzada de estabilización y madurez del proceso
de compostaje, donde disminuye la actividad biodegradadora de la celulosa y
los microorganismos responsables de esta función (4, 35).
De los 93 aislamientos bacterianos 70 resultaron bacilos Gram-positivos, catalasa
positiva, formadoras de endosporas y crecieron en aerobiosis. Estas características
se relacionan con bacterias pertenecientes al género Bacillus; según el método
clásico de identificación de microorganismos que utiliza como criterio de diferenciación
los caracteres fenotípicos, morfológicos y fisiológicos (21, 36). La observación
de la morfología y esporulación, la respuesta a la tinción de Gram y algunas
pruebas bioquímicas permiten, en el caso de Bacillus spp., ubicarlos dentro
de su género (37).
Determinación cualitativa de la capacidad celulolítica y crecimiento microbiano
En la Tabla II se muestran
los 30 aislamientos bacterianos que tuvieron respuesta positiva en cuanto a
la capacidad celulolítica. El 57 % de estas bacterias pertenecen al área cañera;
del área orgánica y convencional se obtuvo el 13 %; el restante 17 % corresponde
al ambiente bosque. Los aislamientos bacterianos del compost no mostraron actividad
celulolítica alguna, lo cual tiene concordancia con otros estudios donde se
obtuvo un número reducido de bacterias con capacidad celulolítica al emplear
agar CMC para el aislamiento a partir del compostaje avanzado de residuos provenientes
de cultivos de Stevia rebaudiana y diferentes sustratos naturales de sabanas
en pastoreo y de bosques de sabana inundable tropical (22, 38).
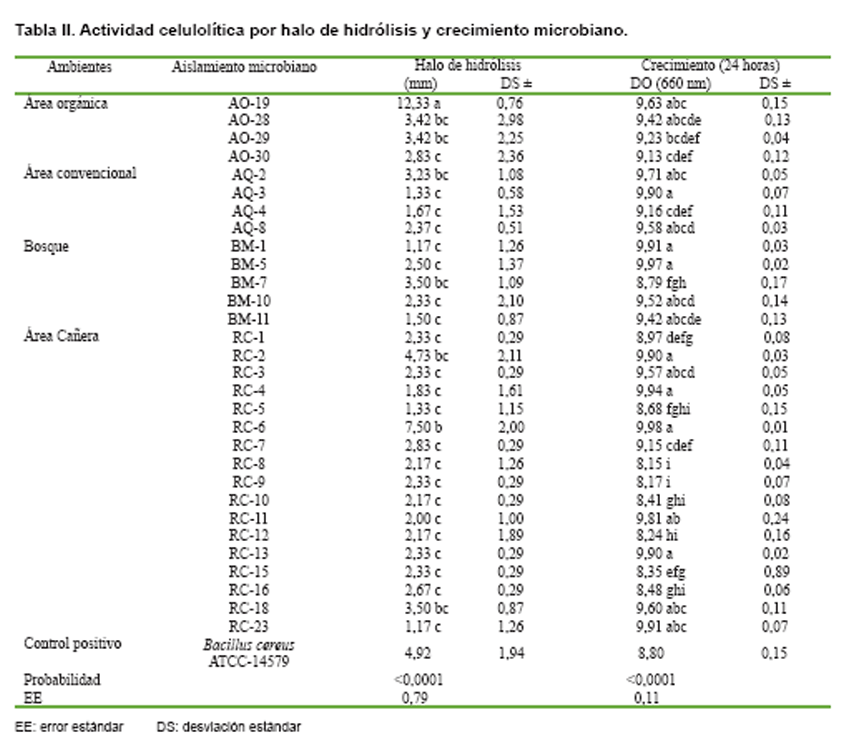
En términos generales, los aislamientos bacterianos mostraron un comportamiento
diferencial en las dos variables evaluadas. La bacteria AO-19 presentó el mayor
halo de degradación de la celulosa con 12,33 mm, siendo estadísticamente diferente
al resto de los aislamientos bacterianos, además de presentar un elevado crecimiento
en el medio aunque sin diferencias respecto a algunas de las bacterias analizadas.
Los aislamientos bacterianos que se ubicaron en las dos primeras categorías
estadísticas en la variable halo de hidrólisis (AO-19; AO-28; AO-29;
AQ-2; BM-7; RC-2; RC-6; RC-18) fueron seleccionados para evaluar capacidad de
crecimiento a diferentes niveles de pH y temperatura, ya que son dos factores
ambientales muy importantes que se presentan, con diferentes valores, durante
las fases del proceso de compostaje de los residuos orgánicos (3, 4). Los restantes
22 aislamientos bacterianos comparten la tercera categoría estadística al obtener
promedios de halo de hidrólisis por debajo de 3 mm, estos resultados de degradación
de la celulosa coinciden con los obtenidos en otros estudios que no superaron
el valor mencionado anteriormente y por lo cual fueron descartados como posibles
inóculos (22, 39).
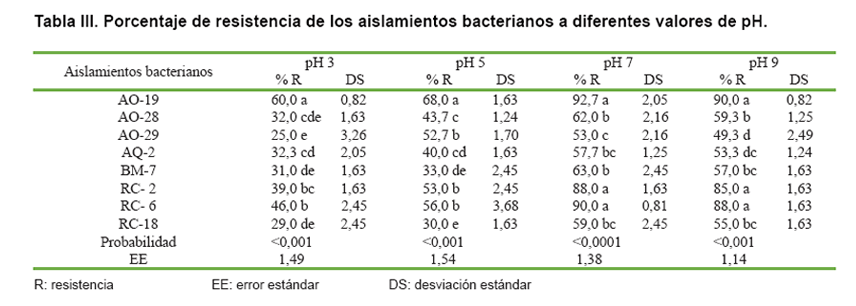
Efecto del pH del medio de cultivo sobre la capacidad de crecimiento
de los aislamientos bacterianos seleccionados
El crecimiento de los aislamientos bacterianos seleccionados se presenta en
la Tabla III. Se puede
apreciar que el aislamiento AO-19 tuvo el mayor crecimiento en los diferentes
valores de pH del medio de cultivo, alcanzando un porcentaje de resistencia
promedio del 77,5 %, convirtiéndose en la bacteria con mayor plasticidad ecológica;
se confirma, además, que los niveles de pH neutro y alcalino del medio de cultivo
son los óptimos para el crecimiento bacteriano del género Bacillus (14, 15,
25). Se debe resaltar que todas las bacterias crecieron en pH ácidos, lo cual
coincide con otros estudios realizados a 43 Bacillus spp., donde se observó
que el 100 % de las cepas evaluadas crecieron a pH 4, 5 y 6 (33).
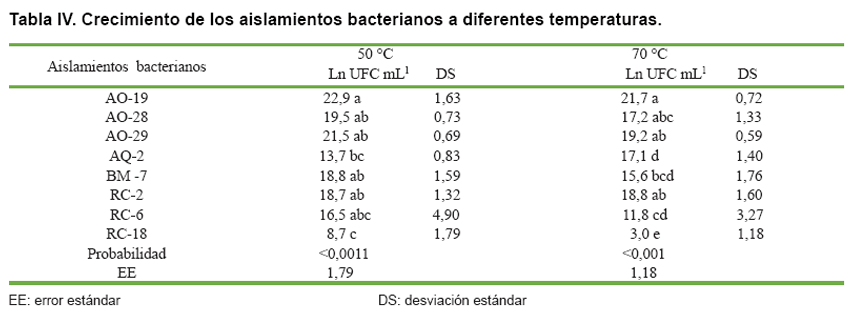
Efecto de la temperatura de incubación sobre el crecimiento de los aislamientos
bacterianos seleccionados
En la Tabla IV se muestran
los resultados de crecimiento de las bacterias, observándose que el aislamiento
AO-19 estuvo entre las de mayor crecimiento en los dos niveles de temperatura
estudiados. Esta es una condición muy importante a considerar en los inóculos
microbianos porque durante el compostaje se producen altas temperaturas, lo
cual es un indicador de la actividad microbiana en la transformación de la materia
orgánica, sobre todo durante la etapa termófila donde tiene lugar la descomposición
de los compuestos fibrosos (9, 10, 17).
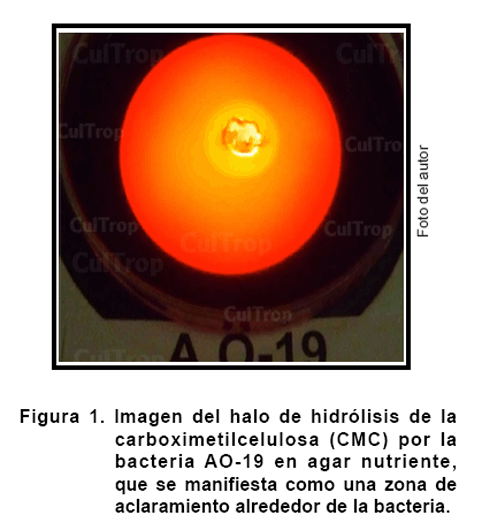
Caracterización de la bacteria AO-19
Los resultados señalan a la bacteria AO-19 como la más promisoria en los aspectos
evaluados, sobre todo en lo relacionado al principal criterio de selección que
es la degradación de la celulosa (Figura 1), por lo que se
procedió a su caracterización en los siguientes aspectos:
Dinámica de crecimiento del aislamiento bacteriano AO-19
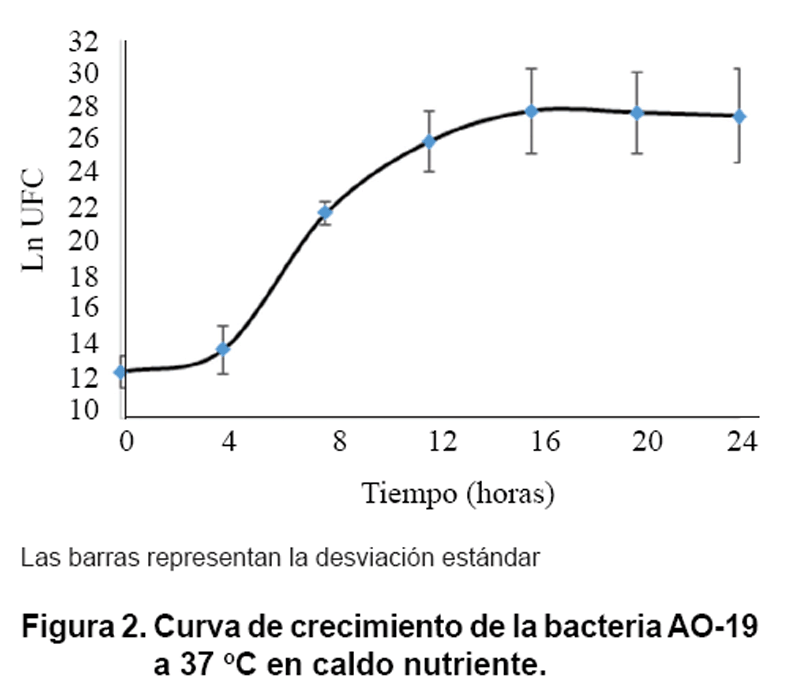
En la Figura 2 se muestra
la curva de crecimiento de la bacteria promisoria AO-19. En las primeras horas
comienza el crecimiento del cultivo que se mantiene en fase logarítmica hasta
las 18 horas. A partir de este momento se inicia la fase estacionaria, hasta
la hora 24, donde las células dejan de multiplicarse por la disminución de nutrientes
y el aumento de sustancias tóxicas en el medio (36, 40).
Actividad amilolítica y pectinolítica del aislamiento bacteriano AO-19
En la Tabla V se presentan
los valores del halo de hidrólisis que indican la capacidad amilolítica y pectinolítica
de la bacteria AO-19, alcanzando 8,08 mm y 1,7 mm, respectivamente; lo cual
se encuentra dentro de los intervalos de 1,5 a 15,0 mm reportados en otros estudios
(5, 41). El aislamiento AO-19 supera en capacidad amilolítica al control positivo
y obtuvo un diámetro de halo muy similar en el caso de la pectina. Estas cualidades
son muy importantes al momento de decidir los tipos de bacterias a inocular
en procesos de compostaje, dada la variable composición química de los residuos
orgánicos (14, 15).
CONCLUSIONES
Bajo las condiciones climáticas de Manabí-Ecuador, los suelos dedicados a la producción de caña de azúcar tienen una alta carga microbiana de bacterias celulolíticas. Sin embargo, del suelo donde se practica agricultura orgánica se obtuvo el aislamiento bacteriano AO-19 con mayor capacidad de degradación de la celulosa y mejor crecimiento a diferentes niveles de pH y temperatura, que son características deseables y necesarias en los inóculos del compostaje, por lo que se recomienda su utilización para este fin.
AGRADECIMIENTOS
A la Escuela Superior Politécnica Agropecuaria de Manabí “Manuel Félix López” por el auspicio y financiamiento de la investigación. Así como a la Universidad Laica “Eloy Alfaro” de Manabí-Ecuador, que proporcionó las facilidades para la realización de este trabajo. Igualmente expresamos nuestro reconocimiento y gratitud a los especialistas de la Facultad de Agronomía de la Universidad de Matanzas “Camilo Cienfuegos” de Cuba que aportaron científicamente en la ejecución de este estudio.
BIBLIOGRAFÍA
1. Varnero, M.;
Galleguillos, K. y Rojas, R. Sistemas de Compostaje para el tratamiento de Alperujo.
Inf. Tecnol., 2011, vol. 22, pp. 49-56. ISSN 0718-0764.
2. Oviedo, R.; Marmolejo, L. y Torres, P. Perspectivas de aplicación del compostaje
de biorresiduos provenientes de residuos sólidos municipales. Un enfoque desde
lo global a lo local. Rev. Ing. Univ., 2012, vol. 11, pp. 67-76. ISSN 1692-3324.
3. Zhang, S. Y.; Wang, Q. F.; Wan, R. y Xie, S. G. Changes in bacterial community
of Anthracene bioremediation in municipal solid waste composting soil. Journal
of Zhejiang University-Science, 2011, vol. 12, pp. 760-768. ISSN 1869-196X.
4. Baldrian, P.; Kolarík, M.; Štursová, M.; Kopecký, J.; Valášková, V.; Vetrovský,
T.; Žifcáková, L.; Šnajdr, J.; Rídl, J.; Vlcek, C. y Voríšková, J. Active and
total microbial communities in forest soil are largely different and highly
stratified during decomposition. ISME J., 2012, vol. 6, no. 2, pp. 248-258.
ISSN 1751-7362.
5. Pérez, Y.; Rebollido, R. y Martínez, J. Isolation and identification of fungi
in compost from municipal solid waste. Agro Sur, 2010, vol. 38, no. 1, pp. 1-7.
ISSN 0304-8802.
6. Castellanos, J. y León, J. Descomposición de hojarasca y liberación de nutrientes
en plantaciones de Acacia mangium (Mimosaceae) establecidas en suelos degradados
de Colombia. Rev. Biol. Trop., 2011, vol. 59, pp. 113-128. ISSN 0034-7744.
7. García, Y.; Ramírez, W. y Sánchez, S. Indicadores de la calidad de los suelos:
una nueva manera de evaluar este recurso. Pastos y Forrajes, 2012, vol. 35,
pp. 125-138. ISSN 2078-8452.
8. Martínez, H.; Fuentes, E. y Acevedo, H. Carbono orgánico y propiedades del
suelo. J. Soil Sc. Plant. Nutr., 2008, vol. 8, pp. 68-96. ISSN 0718-9516.
9. Lymar, E. y Renganathan, V. Purificatión and Characterizatión of a Cellulose-Binding
ß-glucosidase from Cellulose-Degrading Cultures of Phanerochaete chysosporium.
Applied and Environmental Microbiology, 1995, vol. 61, no. 8, pp. 2976-2980.
ISSN 1098-5336.
10. Lan, T. Q.; Wei, D.; Yang, S. T. y Liu, X. Enhanced cellulase production
by Trichoderma viride in a rotating fibrous bed bioreactor. Bioresour Technol,
2013, vol. 5, no. 133, pp. 175-182. ISSN 1873-2976.
11. Quiroz, R. y Folch, J. Plant cell wall degrading and remodeling proteins:
current perspectives. Biotecnol. Apl., 2011, vol. 28, pp. 205-215. ISSN 1027-2852.
12. Izquierdo, A.; Sizova, M. y Lynd, L. Diversity of Bacteria and Glycosyl
Hydrolase Family 48 Genes in Cellulolytic Consortia Enriched from Thermophilic
Biocompost. Applied and Environmental Microbiology, 2010, vol. 76, pp. 3545-3553.
ISSN 1098-5336.
13. Hansel, C. M.; Fendorf, S.; Jardine, P. M. y Francis, C. A. Changes in bacterial
and archaeal community structure and functional diversity along a geochemically
variable soil profile. Appl. Environ. Microbiol, 2008, vol. 74, no. 5, pp. 1620-1633.
ISSN 1098-5336.
14. Chandna, P.; Nain, L.; Singh, S. y Chander, R. Assessment of bacterial diversity
during composting of agricultural byproducts. BMC. Microbiol., 2013, vol. 13,
no. 2, p. 99. ISSN 1471-2180.
15. Shu-Ying, Zhang; Qing-Feng, Wang; Rui, Wan. y Shu-Guang, Xie. Changes in
bacterial community of Anthracene bioremediation in municipal solid waste composting
soil. Journal of Zhejiang University-Science, 2011, vol. 12, no. 9, pp. 760-768.
ISSN 1869-196X.
16. MAGAP (Ministerio de Agricultura, Ganadería, Acuacultura y Pesca). Políticas
de Estado para el desarrollo agropecuario. Quito-Ecuador. 2008. 128 pp.
17. Alvarado, S. Dinámica de la materia orgánica en suelos agrícolas. Ponencia
XI. Congreso ecuatoriano de la ciencia del suelo. Santo Domingo-Ecuador. 2010.
18. Stanier, R. y Ingraham, J. Microbiología. Ed. Reverté S. A. 1996. p. 195.
19. Milian, G.; Pérez, M. y Bocourt, R. Probiotic from Bacillus spp and their
spores in the poultry production. Cuban Journal of Agricultural Science, 2009,
vol. 42, pp. 117-122. ISSN 0864-0408.
20. Harrigan, W. y McCance, M. Métodos de laboratorio de Microbiología. España:
Editorial Academia León. 1968. 426 pp. ISBN 959-7164-91-4.
21. Le, H.; Duc, H.; Hong, T.; Barbosa, A.; Henriques, S. y Cutting, L. Characterization
of Bacillus probiotics available for human use. Appl. Environ. Microbiol., 2004,
vol. 70, pp. 2161-2171. ISSN 1098-5336.
22. Constantino, M.; Gómez, R.; Álvarez, J.; Pat, J. y Espín, E. Efecto de la
inoculación de Azotobacter chroococcum y Glomus intraradices en el crecimiento
y nutrición de plántulas de papaya en fase de vivero. Agron. Costaricense, 2011,
vol. 35, pp. 15-31. ISSN 0377-9424.
23. Ortiz, M. y Uribe, D. Determinación de la actividad lignocelulolítica en
sustrato natural de aislamientos fúngicos obtenidos de sabana de pastoreo y
de bosque secundario de sabana inundable tropical. Cienc. Suelo, 2010, vol.
28, pp. 169-180. ISSN 1850-2067.
24. Nakamura, K.; Haruta, S.; Nguyen, H.; Ishii, M. y Igarashi, Y. Enzyme production-based
approach for determining the functions of microorganisms within a community.
Appl. Environ. Microbiol., 2004, vol. 70, pp. 3329-3336. ISSN 1098-5336.
25. Kwasi, Y.; Mark, L. y Charles, H. Effects of Single and Dual Applications
of Selected Trichoderma and Bacillus Isolates on Performance of Dry Bean Seedlings
Grown in Composted Pine Bark Growth Medium under Shadehouse Conditions. Journal
of Plant Nutrition, 2009, vol. 32, pp. 1271-1289. ISSN 1532-4087.
26. Kociubinski, G.; Pérez, P. y De Antoni, G. Screening of bile resistance
and bile of precipitation in lactic acid bacteria and bifidobacteria. J. Food
Protect., 1999, vol. 62, pp. 905-912. ISSN 1944-9097.
27. Wen-Jing, L.; Hong-Tao, Wang; Yong-feng, Nie; Zhi-Chao, Wang; De-Yang, Huang;
Xiang-yang, Quiu. y Jin-Chun, Chen. Effect of Inoculating Flower Stalks and
Vegetable Waste with Ligno-cellulolytic Microorganisms on the Composting Process.
Journal of Environmental Science and Health, 2012, vol. 39, pp. 871-887. ISSN
1532-4117.
28. Sun, P. y Zhao, X. Recent advances inmicrobial raw starch degrading enzymes.
Applied Biochemistry and Biotechnology, 2010, vol. 160, pp. 988-1003. ISSN 1559-0291.
29. Valencia, M.; Quevedo, B.; Franco, M. y Diez-Ortega, H. Evaluación de actividades
enzimáticas de Fusarium spp. aislados de lesiones en humanos, animales y plantas.
Univ. Sci., 2011, vol. 16, pp. 147-159. ISSN 2027-1352.
30. Balzarini, M. G.; Casanoves, F.; Di Rienzo, J. A.; Gonzalez, L. A.; Robledo,
C. W.; Tablada, E. M. InfoStat, versión 1. Manual del Usuario. Primera edición.
Ed. Triunfar. 2001. pp. 231. ISBN 987-43-4509-8.
31. Alcarraz, M.; Flores, A. y Godoy, J. Producción de celulasas por inmovilización
celular para el tratamiento de efluentes industriales lignocelulósicos. Rev.
Inst. investig. Fac. minas metal cienc. Geogr., 2010, vol. 13, pp. 97-102. ISSN
1682-3087.
32. Peláez, A.; Meneses, M.; Romero, A.; Ayala, M.; Galván, A.; Corral, O. y
Megías, D. Enzimas fibrolíticas producidas por fermentación en estado sólido
para mejorar los ensilajes de caña de azúcar. Agrociencia, 2011, vol. 45, pp.
675-685. ISSN 1405-3195.
33. Martínez, E.; Fuentes, J. y Acevedo, E. Carbono orgánico y propiedades del
suelo. J. Soil Sc. Plant Nutr., 2008, vol. 8, pp. 68-96. ISSN 0718-9516.
34. Barrios, M.; García, J. y Basso, C. Efecto de la fertilización nitrogenada
sobre el contenido de nitrato y amonio en el suelo y la planta de maíz. Bioagro,
2012, vol. 24, pp. 213-220. ISSN 1316-3361.
35. Zúñiga, M. y Calvo, D. Caracterización fisiológica de cepas de Bacillus
spp. aisladas de la rizosfera de papa (Solanum tuberosum). Ecología Aplicada,
2010, vol. 9, pp. 31-39. ISSN 1993-9507.
36. Mayea, S.; Novo, R.; Boado, I.; Silveira, E.; Soria, M.; Morales, Y. y Valiño,
A. Microbiología Agropecuaria. Tomo 1. 1997. pp. 15-52. . ISBN 9590701272.
37. Sosa, A.; Álvarez, V.; Torres, D. y Casadesús, L. Identificación y caracterización
de seis aislados pertenecientes al género Bacillus promisorios para el control
de Rhizoctonia solani Künh y Sclerotium rolfsii Sacc. Fitosanidad, 2011, vol.
15, pp. 39-44. ISSN 1818-1686.
38. Gutiérrez, V.; Pinzón, Á.; Casas, J. y Martínez, M. Determinación de la
actividad celulolítica del suelo proveniente de cultivos de Stevia rebaudiana
Bertoni. Agronomía colombiana, 2008, vol. 26, pp. 497-504. ISSN 0120-9965.
39. Mikán, J. y Castellano, D. Screening para el aislamiento y caracterización
de microorganismos y enzimas potencialmente útiles para la degradación de celulosas
y hemicelulosas. Revista Colombiana de Biotecnología, 2004, vol. 6, pp. 58-71.
ISSN 1909-8758.
40. Sánchez, C.; Mejía, C.; Figueroa, C.; Esquivia, M.; Agudelo, L.; Zapata,
N. y Gómez, M. Estudio de cepas nativas amilolíticas. Revista de la Facultad
de Química Farmacéutica, 2005, vol. 12, pp. 21-28. ISSN 2145-2660.
41. Rodríguez, Z.; Boucourt, J.; Rodríguez, N.; Albelo, O.; Nuñez, F. y Herrera,
R. Aislamiento y selección de microorganismos con capacidad de degradar el almidón.
Revista cubana de ciencia agrícola, 2006, vol. 40, no. 3, pp. 349-354. ISSN
2079-3472.
Recibido: 19 de
julio de 2013
Aceptado: 15 de abril de 2014
Ms.C. Ángel M. Guzmán Cedeño, Escuela Superior Politécnica Agropecuaria de Manabí "Manuel Félix López", 10 de agosto no. 82 y Granda Centeno. Calceta. Manabí, Ecuador.Email: aguzman@espam.edu.ec