
Caracterización
de aislados de rizobios provenientes de nódulos de soya (Glycine max (L.) Merril)
con potencialidades en la promoción del crecimiento vegetal
Caracterization
of rizobia isolates from soybean nodules (Glycine max (L.) Merril) with potenciality
to promote
the plant growth
Ionel Hernández
Forte, Dra.C. María C. Nápoles García, Belkis Morales Mena
Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas. Mayabeque, CP 32700, Cuba.
RESUMEN
El objetivo del presente trabajo fue caracterizar cuatro aislados de rizobios y la cepa Bradyrhizobium elkanii ICA 8001 provenientes de nódulos de plantas de soya, en cuanto a su capacidad para exhibir tres atributos positivos que caracterizan estas rizobacterias promotoras del crecimiento vegetal. Se determinó su capacidad de producir sideróforos; AIA (ácido 3-indolacético) y la actividad específica de la enzima 1-aminociclopropano-1-ácido carboxílico (ACC) desaminasa. Solo el aislado S11 produjo sideróforos en el medio de cultivo. Aunque todos los aislados y la cepa produjeron AIA, S11 produjo las mayores concentraciones de esta fitohormona. Todos los aislados, excepto S11, mostraron actividad de la enzima ACC desaminasa cuando se cultivaron en presencia del precursor 1-aminociclopropano-1-ácido carboxílico. La caracterización realizada permitió conocer atributos beneficiosos que brindan ventajas en la competitividad de estas bacterias en la rizosfera del cultivo, los que en conjunto con su capacidad de realizar la Fijación Biológica del Nitrógeno (FBN), pudieran incrementar el crecimiento de plantas de soya.
Palabras clave: sideróforos, Rhizobium, rizobacterias
ABSTRACT
The objective of this work was to characterize four rhizobia and isolated from soybean nodules about three positive attributes which characterize these promoting growth plant rizobacterias. The siderophores and indol acetic acid (AIA) production and the specific activity of 1-aminocyclopropane-1-carboxylate (ACC) desaminase enzyme, were determinated. Siderophore was produced only by S11 isolated. All bacterial isolates and the strain produced IAA, but S11 produced the highest concentrations. All isolates, except S11, showed ACC deaminase enzyme activity when they were cultivated with the ACC precursor. The characterization allowed to know beneficial attributes, which represent advantages in the competitiveness of these bacterias in the crop rhizosphere, which together with their ability to perform the biological nitrogen fixation, could promote soybean plants growth.
Key words: siderophores, Rhizobium, rhizobacteria
INTRODUCCIÓN
Las bacterias
promotoras del crecimiento vegetal PGPB, por sus siglas en inglés, se asocian
a muchas especies de plantas presentes en la mayoría de los ecosistemas (1).
Este grupo bacteriano tiene la capacidad de aumentar la disponibilidad de nutrientes,
transformarlos a formas asimilables por la planta, producir sustancias promotoras
del crecimiento fitohormonas o servir como control biológico de fitopatógeno
denominándose entonces de biocontrol-PGPB (2). Dentro del primero de estos grupos
bacterianos se encuentran los rizobios, microorganismos que se asocian simbióticamente
con las leguminosas, alojándose en el interior de estructuras especializadas
denominadas nódulos. Estos órganos constituyen el hábitat propicio donde se
realiza la Fijación Biológica de Nitrógeno (FBN) (3).
La FBN, en conjunto con la producción de sideróforos, de ácido 3-indolacético
(AIA) y la producción de la enzima 1-aminociclopropano-1-ácido carboxílico (ACC)
desaminasa, constituyen algunos de los mecanismos directos en la promoción del
crecimiento de las plantas (4, 5).
Algunas cepas de rizobios tienen la capacidad de producir sideróforos, biomoléculas
que actúan como agentes quelantes específicos de hierro, muchas veces no disponible
para los organismos vivos e indispensable para la realización de funciones vitales
como la síntesis de ADN, la respiración, la fotosíntesis y la FBN (6). Así mismo
los sideróforos son utilizados por los rizobios para disminuir las concentraciones
de hierro disponible en el suelo y con ello inhibir la proliferación de microorganismos
fitopatógenos (7).
Por otra parte, el ácido 3-indolacético es una auxina que regula el crecimiento
en las plantas, ya que activa varias repuestas en la célula vegetal a nivel
bioquímico, fisiológico y morfológico. Tal efecto se visualiza en la división,
elongación y diferenciación celular, en la formación de raíces laterales y de
pelos radiculares, así como en la apoptosis y la morfogénesis (8).
El etileno, fitohormona producida por las plantas, constituye un inhibidor en
la progresión de la infección de los rizobios en el proceso simbiótico con las
leguminosas. Para contrastar esto, algunos rizobios producen la enzima ACC desaminasa,
con lo cual disminuyen la concentración del etileno y de sus efectos inhibidores
en la nodulación (9).
A pesar de que está bien documentada en la literatura el efecto beneficioso
que ocasionan estos metabolitos producidos por las PGPB en la promoción del
crecimiento vegetal, aún son limitadas las investigaciones que abordan la producción
de estos compuestos por los rizobios. Teniendo en cuenta lo anteriormente planteado
el objetivo del presente trabajo fue caracterizar cuatro aislados de rizobios
provenientes de nódulos de plantas de soya y la cepa B. elkanii ICA 8001, en
cuanto a su capacidad para producir sideróforos, metabolitos del tipo AIA y
a la presencia de la enzima ACC desaminasa, como atributos positivos que caracterizan
estas PGPB.
MATERIALES Y MÉTODOS
El estudio se
realizó en el Departamento de Biología de la Universidad de Waterloo, Canadá
y en el Departamento de Fisiología y Bioquímica Vegetal, del Instituto Nacional
de Ciencias Agrícolas (INCA), Cuba.
Material microbiano
Se emplearon cuatro aislados de rizobios S1, S10, S11, Snb y la cepa Bradyrhizobium
elkanii ICA 8001 (10). Todos estos microorganismos provienen de nódulos de plantas
de soya (Glyxine max) y actualmente pertenecen al cepario del Laboratorio de
Bacteriología, del Departamento de Fisiología y Bioquímica Vegetal del INCA.
Según estudios anteriores, donde se aplicaron los métodos convencionales de
identificación de rizobios velocidad de multiplicación y producción de ácido-base,
S11 pertenece al género Rhizobium y el resto de los aislados al género BradyrhizobiumA.
Se realizaron tres ensayos, donde se determinó la producción de sideróforos,
la producción de metabolitos del tipo AIA y la actividad de la enzima ACC desaminasa.
Se prepararon cultivos de los diferentes aislados bacterianos en Erlenmeyers
de 25 mL de volumen, conteniendo 5 mL de medio líquido Manitol Extracto de Levadura
YEM, por sus siglas en inglés (11). Los medios se inocularon con una asada de
cada aislado de rizobio previamente conservados a 4 oC en tubos de
ensayo en el mismo medio de cultivo sólido. Los cultivos líquidos se incubaron
a 30 oC, en condiciones de agitación a 150 r min-1 Optic ivimen system-Comecta
durante 24 h para el aislado S11 y 72 h para el resto. En el caso específico
de la determinación de producción de metabolitos del tipo AIA, los medios de
cultivo se suplementaron con dos concentraciones de triptófano 200 y 500 µg
mL-1 en el momento de su preparación. Como control del experimento se emplearon
medios de cultivo sin triptófano.
Determinación de la producción de sideróforos
Se tomaron tres alícuotas de 10 µL de los cultivos bacterianos y se colocaron
en placas Petri que contenían medio sólido Cromo Azurol Sulfonato CAS Agar (12).
Las placas se incubaron WiseCube-Daihan-brand de tres a cinco días a 28 oC.
Finalmente se evaluó la producción de sideróforos, a partir de la presencia
de halos de coloración naranja formados alrededor del crecimiento microbiano
(13). Alícuotas de 10 µL de medio de cultivo estéril se colocaron en placas
con el medio CAS Agar, las que se utilizaron como control del experimento.
Producción de metabolitos del tipo ácido 3-indolacético
(AIA)
Los cultivos bacterianos inducidos se centrifugaron a 8000 r min-1
y 4 oC durante 10 min Centrífuga 5804R, Eppendorf. Se añadió 1 mL
de cada sobrenadante obtenido en 4 mL del reactivo de Salkowski (14) y se incubaron
durante 20 minutos a temperatura ambiente. La producción de metabolitos del
tipo AIA se detectó en espectrofotómetro Genesys 6, Thermospectronic a 535 nm.
La concentración de AIA se determinó mediante una curva de calibración, con
un rango de concentración de 10-400 µg mL-1 de AIA (SIGMA) y los
resultados se expresaron en µg mL-1.
Determinación de la actividad de la enzimática ACC desaminasa
Los cultivos bacterianos se centrifugaron a 8000 r min-1 y 4 oC durante
10 min Centrífuga 5804R, Eppendorf. Para inducir la síntesis de la ACC desaminasa,
los sedimentos celulares se lavaron dos veces con 5 mL del medio mínimo salino
M9 estéril (15). Posteriormente se resuspendieron con 7,5 mL del mismo medio
estéril suplementado con 0,05 Mol L-1 de 1-aminociclopropano-1-ácido
carboxílico (ACC) (SIGMA), como única fuente de nitrógeno. Los aislados se cultivaron
entonces a 150 r min-1 Optic ivimen system-Comecta y una temperatura
de incubación que osciló entre los 28-30 oC, durante 24 horas para
el aislado S11 y 72 h para el resto. Seguidamente, se determinó la actividad
ACC desaminasa mediante la cuantificación de la producción de a-cetobutirato
generado a partir del ACC (16).
Simultáneamente, para calcular la actividad específica de la enzima ACC desaminasa,
se determinó la concentración de proteínas totales en el extracto bacteriano,
según el método de Bradford (17). Se utilizó albúmina de suero bovino SIGMA
como estándar para la curva de calibración, con un rango de concentración de
10-100 µg mL-1. La actividad específica de la enzima ACC desaminasa
se expresó en µg de a-cetobutirato µg-1 proteína h-1.
Diseño y análisis estadístico
Los datos obtenidos de los ensayos donde se evaluó la producción de metabolitos
del tipo AIA y la actividad de la enzima ACC desaminasa, se sometieron a la
prueba de normalidad test de Bartlett y homogeneidad de varianza test de Kormogorov-Smirnov
y se aplicó análisis de varianza de clasificación simple, utilizando el Test
de comparación de medias de Tukey para p<0,05 para discriminar diferencias
entre las medias (18). Los datos se graficaron utilizando el programa SigmaPlot
2001. En cada caso, incluyendo el ensayo de determinación de sideróforos, se
realizaron cuatro réplicas por tratamiento.
RESULTADOS
Y DISCUSIÓN
Producción de sideróforos por los aislados de rizobios
De los cuatro aislados de rizobios empleados en este estudio y la cepa B. elkanii
ICA 8001, solo S11 tuvo la capacidad de producir sideróforos (Figura
1).

Se observaron halos de coloración naranja intensa alrededor de las colonias
producidas por este aislado, a diferencia del resto de los microorganismos estudiados
que no se multiplicaron en este medio. Este medio de cultivo, con una coloración
azul al momento de su preparación, se torna naranja en aquellas zonas donde
crecen microorganismos con la capacidad de producir sideróforos (13).
Similares resultados a los obtenidos en este ensayo fueron observados en estudios
realizados con diez cepas del género Rhizobium, procedentes de garbanzo (Cicer
arietinum), donde en seis de ellas se detectaron halos de coloración naranja
con diámetros entre 1,0-2,22 mm (19).
El medio de cultivo Cromo Azurol Sulfonato es usualmente empleado para la determinación
cualitativa de sideróforos, pues presenta muy bajas concentraciones de hierro
(1 mM FeCl3.6H2O), condición esencial para que se induzca la síntesis de sideróforos
en aquellos microorganismos con capacidad de producirlos (20). En tales condiciones,
el Fe2+ presente en el interior de la célula microbiana, se disocia de las proteínas
represoras que se encuentran unidas al ADN para impedir la síntesis de los sideróforos
ante altas concentraciones de hierro. Las PGPR que producen sideróforos utilizan
el complejo Fe3+-sideróforos para incorporar este metal al interior celular
mediado por un receptor específico localizado en la membrana bacteriana. Este
secuestro de hierro disminuye su disponibilidad en el medio para otros microorganismos
carentes de este sistema y que en ocasiones son patógenos para las plantas (13).
Se conoce que los rizobios tienen la capacidad de producir diversos tipos de
sideróforos; sin embargo, solo algunos de ellos han sido estructuralmente caracterizados.
En bacterias del género Rhizobium en forma de vida libre en la rizosfera, se
han detectado sideróforos del tipo hidroxamatos (21). Aun está por determinar
cuáles son los mecanismos que utilizan los bacteroides en el interior del nódulo
radicular para la incorporación del hierro, ya que se ha detectado que aproximadamente
el 44 % del hierro presente en las plantas de soya se encuentra localizado en
estas estructuras (22).
Se ha demostrado la importancia que tiene para los rizobios la captación de
hierro en el proceso de FBN, que realizan en simbiosis con las plantas leguminosas.
La nitrogenasa, metaloenzima esencial en este proceso y que constituye del 10-12
% del total de las proteínas de las células de rizobio, cataliza la reducción
del nitrógeno molecular a amonio, por medio de reacciones redox dependientes
de hierro. De manera indirecta también este metal contribuye a la FBN, ya que
forma parte importante de los citocromos, moléculas esenciales en el proceso
de respiración celular, a partir del cual se obtiene la energía necesaria para
el proceso de fijación del nitrógeno (23). Evidencias del papel importante que
juega la captación de hierro por los rizobios en simbiosis con las leguminosas,
se muestran explícitamente en experimentos realizados con Sinorhizobium meliloti,
donde se observó una disminución en la ocupación de los nódulos por las cepas
mutantes con deficiencias en la síntesis de sideróforos, en comparación con
las cepas salvajes (24).
Producción de metabolitos del tipo ácido 3-indolacético por los aislados
de rizobios
Todos los aislados bacterianos y la cepa B. elkanii ICA 8001 produjeron AIA,
aunque con diferencias en su concentración. Los valores de AIA obtenidos en
los medios que fueron suplementados con triptófano, oscilaron aproximadamente
entre 3 µg mL-1 (para S10) y 47 µg mL-1 para S11 (Figura
2). Estas concentraciones fueron inferiores a los encontrados en otros estudios
realizados con diferentes cepas de rizobios, donde en las mismas condiciones
de cultivo, las cantidades de esta fitohormona fueron de 126 µg mL-1
(25) y 142,5 µg mL-1 (26). El aislado S11 mostró la capacidad de
producir las mayores concentraciones de AIA, de 29 y 45 µg mL-1 en
los medios suplementados con 200 y 500 µg mL-1 de triptófano, respectivamente.
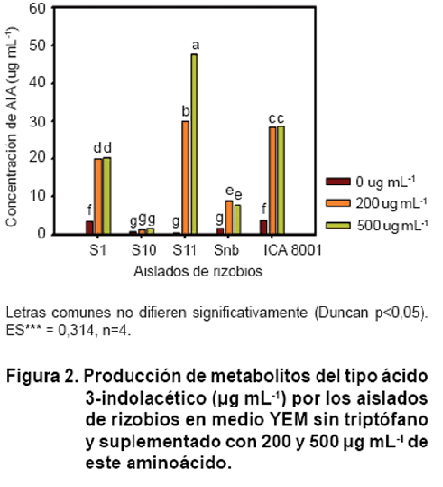
En
los aislados de rizobios y la cepa B. elkanii ICA 8001, excepto S11, no se evidenció
una relación directamente proporcional entre la concentración de triptófano
y la concentración de AIA producida, ya que el aumento en la concentración de
triptófano en el medio de cultivo no significó un incremento en la concentración
de AIA. Desde el punto de vista bioquímico existen varias causas que pudieran
dar explicación a este fenómeno, sobre todo los aspectos relacionados con las
enzimas que participan en cada una de las vías metabólicas involucradas. Para
esclarecer esto sería necesario realizar determinados análisis isoenzimáticos
e incluso genéticos que permitan dilucidar la verdadera causa de este comportamiento
en los diferentes microorganismos estudiados.
Para todos los microorganismos estudiados, con excepción del aislado S10 se
observa una inducción en la síntesis de AIA cuando fueron cultivados en medios
suplementados con triptófano. Este precursor se utiliza comúnmente para la inducción
de la síntesis del AIA pues se conoce que la formación de esta fitohormona es
producto de determinadas rutas metabólicas cuyo precursor es este aminoácido.
Hasta el momento se han descrito cuatro vías dependientes de triptófano presentes
en las rizobacterias: la del ácido indol-3-pirúvico (IPyA), la vía de la triptamina
(TAM), del indol-3-acetonitrilo (IAN) y la vía de la indol-3-acetamida (IAM).
Se ha descrito, fundamentalmente en plantas, una quinta vía de síntesis de AIA
independiente de triptófano, en la que se presume que el precursor de la misma
es el indol-3-glicerol fosfato (27). Los resultados en este trabajo indican
que el aislado S10, aunque en concentraciones muy bajas, tuvo la capacidad de
producir AIA en ausencia de triptófano.
Resultados similares se obtuvieron en investigaciones llevadas a cabo con aislados
de rizobios nativos de suelos amazónicos en los que incrementos de las concentraciones
de triptófano en el medio de cultivo no aumentaron la producción de AIA por
estos aislados bacterianos (25).
Estudios realizados con determinadas cepas de Azospirillum, concluyen que la
vía independiente de triptófano se convierte en la mayor fuente de AIA cuando
las bacterias son crecidas en medios sin el precursor (28). Existen referencias
en cepas de Streptomyces sp. y Flavobacterium sp., donde se ha comprobado que
el amonio es el precursor de la síntesis de AIA, ya que en ausencia de esta
molécula las cepas son incapaces de sintetizar esta auxina. Se presume que esto
se deba a la competencia de esta molécula y el triptófano por los sitios activos
de determinadas enzimas en el proceso biosintético del AIA (29). Tales resultados
podrían sugerir la existencia de vías independientes del triptófano para la
síntesis del AIA en el aislado S10. Los niveles moderados de AIA obtenidos en
el aislado S1 y Snb y la cepa ICA 8001, crecidos en los medios sin triptófano,
podrían también sustentar esta hipótesis.
Tal como se ha dicho, muchos estudios se han enfocado en la determinación cuantitativa
de AIA producido por cepas de rizobios pertenecientes al género Rhizobium. Sin
embargo, es en ejemplares del género Bradyrhizobium mayoría de los microorganismos
aquí estudiados, donde más se ha estudiado el efecto de esta auxina en la tolerancia
a determinados tipos de estrés abióticos y por tanto en el aumento de su sobrevivencia
en la rizosfera (30).
El AIA también desempeña un papel importante en el proceso de FBN que tiene
lugar entre las plantas leguminosas y los rizobios. A través de este proceso
metabólico, la enzima nitrogenasa presente en estos microorganismos, cataliza
la reducción del nitrógeno molecular a amonio. El amonio también se ha encontrado
como uno de los precursores en la síntesis del AIA, pero muy pocos estudios
se han realizado para esclarecer el papel de esta molécula. Se ha observado
que cepas de Rhizobium no solo tienen la capacidad de producir AIA cuando se
encuentran en vida libre en el suelo, sino también dentro de los nódulos de
las plantas de soya como bacteroides, una vez establecida la simbiosis (31).
Los rizobios dentro del nódulo radicular pudieran utilizar parte del NH+4, producto
del proceso de FBN, para la síntesis de AIA.
Estudios realizados con cepas mutantes hiperproductoras de AIA de B. japonicum
en el cultivo de la soya demostraron un incremento del volumen y número de los
nódulos radicales efectivos en la FBN, trayendo consigo un efecto positivo en
los rendimientos del cultivo (32). De manera similar, en investigaciones realizadas
con plantas de soya el número de nódulos se redujo al inocular cepas con incapacidad
para producir AIA (33).
La síntesis de fitohormonas como el AIA por microorganismos del suelo, que además
tienen la capacidad de fijar el nitrógeno atmosférico, constituye un beneficio
adicional que permite promover el crecimiento de los cultivos de leguminosas
y con ello incrementar los rendimientos y la calidad de las cosechas.
Actividad de la enzima 1-aminociclopropano-1-carboxilato (ACC) desaminasa
Al analizar la actividad enzimática ACC desaminasa de los diferentes extractos
bacterianos, todos los aislados, excepto S11, mostraron actividad de esta enzima
cuando se cultivaron en presencia del inductor. Un comportamiento similar se
evidenció cuando se observó un incremento significativo en la actividad de la
enzima ACC desaminasa de los medios inducidos con respecto al control de estos
aislados sin inducir (Figura 3).
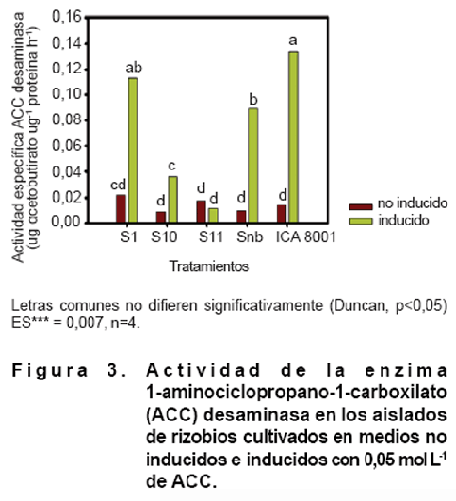
La actividad de la enzima ACC desaminasa en los aislados estudiados fluctuó entre 0,01 (S11) y 0,13 (ICA 8001) a-cetobutirato µg-1 proteína h-1. La presencia de la enzima ACC desaminasa en los rizobios ha sido ampliamente descrita en la literatura (9). Sin embargo, la actividad de esta enzima varía, incluso entre cepas del mismo género. Esto se debe a que la secuencia de nucleótidos que forman el gen acdS (que codifica para la ACC desaminasa) es muy variable entre géneros bacterianos, incluso entre especies del mismo género (34). Esto pudiera explicar las diferencias encontradas en los valores de actividad enzimática en los aislados S1, S10, Snb y la cepa ICA 8001, todos del género Bradyrhizobium.
Estudios filogenéticos
sugieren que el gen acdS no siempre se localiza en el cromosoma microbiano,
sino que también se ha detectado con cierta estabilidad en plásmidos bacterianos.
Además se ha planteado que estos paquetes genómicos pueden transferirse horizontalmente,
provocando la pérdida, en alguna medida, de la capacidad de sintetizar la enzima
ACC desaminasa (35). Esto pudiera ser una posible explicación de los bajos niveles
de actividad enzimática obtenidas en el aislado S11, aun en el medio suplementado
con el inductor. En este sentido, se han utilizado técnicas de biología molecular
con el objetivo de potenciar la producción de la ACC desaminasa en los rizobios
y con ello crear cepas más competitivas en el proceso de nodulación (36). Esta
tecnología pudiera utilizarse para la elaboración de inoculantes más efectivos
para las leguminosas, que contribuyan positivamente a lograr mayores rendimientos
agrícolas, teniendo en cuenta además, el papel de esta enzima en la disminución
de los efectos adversos de determinados estreses bióticos y abióticos (34, 37).
La enzima ACC desaminasa degrada el ACC, precursor del etileno, en a-cetobutirato
y amonio, metabolitos muy comunes en las plantas y otros organismos (38). Se
conoce que la promoción del crecimiento vegetal se estimula no sólo por un decremento
en el contenido de etileno, sino también por la generación de amonio a partir
del ACC llevada a cabo por rizobacterias como los rizobios (35). Con esta estrategia
las plantas disponen de una fuente extra de nitrógeno y los microorganismos
asociados tienen una alternativa más para su supervivencia en la rizosfera.
De esta manera, las PGPR con capacidad de producir la enzima ACC desaminasa,
incrementan su proliferación en los sitios de colonización de las raíces y son
favorecidas ante la competencia con otros microorganismos. En el caso particular
de la interacción simbiótica rizobio-leguminosa, se ha observado que el etileno
determina el sitio específico de la raíz donde se formará el primordio nodular,
ya que mutantes de leguminosas insensibles a esta fitohormona presentan un mayor
número de primordios nodulares que las plantas salvajes (39). De esta forma,
el rizobio degrada el ACC exudado por la raíz, disminuyendo las concentraciones
de etileno en la planta y con ello la disminución de sus efectos inhibitorios
sobre la nodulación (9).
Para explicar el efecto promotor del crecimiento que realizan las PGPR en las
plantas, se han identificado dos tipos de mecanismos, los indirectos o de biocontrol
y los directos de promoción del crecimiento vegetal. El primero se caracteriza
por la existencia de una actividad antagónica entre el microorganismo de interés
con un fitopatógeno, provocando la disminución de los efectos dañinos de este
último sobre la planta (40). La competencia por nutrientes, minerales y espacio,
la detoxificación de factores de virulencia de los patógenos, la inducción de
resistencia sistémica en la planta y la síntesis de metabolitos como los antibióticos
y los sideróforos son algunos de estos mecanismos (41). Los mecanismos directos
de promoción del crecimiento se evidencian en ausencia de otros microorganismos
e incluyen además de la FBN, la producción de enzimas como la ACC desaminasa,
la solubilización de minerales como el fósforo y la síntesis de fitohormonas
como las giberelinas, citoquininas y el AIA (42). La clasificación anteriormente
descrita solo ha servido para estudiar con un mayor nivel de profundidad cada
uno de ellos, pues se conoce que la actividad promotora del crecimiento que
realizan las PGPB como los rizobios, es el resultado de la acción de múltiples
de estos mecanismos simultáneos.
Tanto los mecanismos directos como los indirectos pueden funcionar, además,
potenciándose entre ellos y contribuyendo a la realización de procesos beneficiosos
para la planta como la FBN. La captación de hierro por los rizobios a través
de los sideróforos, favorece la síntesis de la nitrogenasa, así como de otras
moléculas que participan en la generación de la energía necesaria para llevar
a cabo la fijación. El amonio que se genera de este proceso, así como el obtenido
de la degradación del ACC por la ACC desaminasa y el triptófano presente en
las células radicales, pudieran utilizarse por los microorganismos para sintetizar
el AIA, que de conjunto con el AIA producido por la planta, estimulan la proliferación
y la elongación celular. El AIA, a su vez, induce la síntesis de la ACC sintasa,
la cual cataliza la formación de ACC (43) y además estimula la producción de
la ACC desaminasa (39), con lo cual varios procesos se interconectan favorablemente.
Al aumentar la concentración de ACC en la raíz, ocurre su degradación por la
ACC desaminasa producida por los rizobios, disminuyendo la concentración de
etileno y favoreciendo una mayor cantidad de sitios para la proliferación nodular.
De esta manera se pudiera pensar en un complejo diálogo molecular entre los
rizobios y la planta leguminosa, desde su acercamiento y durante el establecimiento
de la simbiosis, garantizando una mayor efectividad en el proceso de fijación
del nitrógeno y en la promoción del crecimiento vegetal.
La caracterización realizada en este trabajo a cuatro aislados de rizobios y
la cepa B. elkanii ICA 8001, obtenidos de nódulos de soya, permitió conocer
que todos produjeron AIA, mientras que el aislado S11 fue el único con la capacidad
de producir sideróforos y sin actividad de la enzima ACC desaminasa. Estos atributos
positivos, presentes de manera particular en estas bacterias, ejercen diferentes
efectos sensibles sobre la planta y constituyen a su vez ventajas en la competencia
con otros microorganismos que también colonizan la rizosfera. El aporte de hormonas
del crecimiento vegetal, la posibilidad de asimilar formas insolubles de nutrientes
como el hierro y de tolerar estreses bióticos y abióticos, sin mencionar que
participan indirectamente en procesos tan importantes como la FBN, son algunos
beneficios directos derivados de esta contribución.
Estos resultados, junto a otros estudios de caracterización de estos aislados
en su interacción con los cultivos, constituyen un aporte en la selección de
cepas que pudieran tributar positivamente sobre la nutrición, protección y desarrollo
de cultivos de interés.
CONCLUSIONES
Los cuatro aislados y la cepa B. elkanii ICA 8001, además de fijar nitrógeno, exhiben al menos dos de las características evaluadas: producción de AIA, sideróforos y actividad de la enzima ACC desaminasa; características que los hacen atractivos para su utilización como posibles biofertilizantes que ayuden a promover el crecimiento y rendimiento del cultivo de la soya.
BIBLIOGRAFÍA
1. Martinez-Viveros,
O.; Jorquera, M. A.; Crowley, D. E. /et al./. Mechanisms and practical considerations
involved in plant growth promotion by rhizobacteria. J. Soil. Sci. Plant. Nutr.,
2010, vol. 10, pp. 293-319. ISSN 1522-2624.
2. Bashan, Y. y Holguin, G. Proposal for the division of Plant Growth-Promoting
Rhizobacteria into two classification: biocontrol-PGPB (Plant Growth-Promoting
Bacteria) and PGPB. Soil Biol. Biochem., 1998, vol. 30, no. 8-9, pp. 1225-1228.
ISSN 0038-0717.
3. Verma, J. P.; Yadav, J.; Tiwari, K. N. /et al./. Impact of plant growth promoting
rhizobacteria on crop production. Int. J Agric. Res., 2010, vol. 5, no. 11,
pp. 954-983. ISSN 0976-058X.
4. Bashan, Y. y de-Bashan, L. E. How the plant growth-promoting bacterium Azospirillum
promotes plant growth-a critical assessment. Chapter two. Adv. Agron., 2010.
vol. 108, pp. 77-136. ISSN 0065-2113.
5. Machado, R. G.; Saccol de Sá, E. L.; Bruxel, M.; Giongo, A.; da Silva Santos,
N. y Schönhoffen, A. Indoleacetic acid producing rhizobia promote growth of
Tanzania grass (Panicum maximum) and Pensacola grass (Paspalum saurae). Int.
J. Agric. Biol., 2013, vol. 15, pp. 827-834. ISSN 15608530, 18149596.
6. Arif, K.; Archana, G. y Desai Anjana, J. Engineering heterologous iron siderophore
complex utilization in rhizobia: Effect on growth of peanut and pigeon pea plants.
Applied Soil Ecology, 2012, vol. 53, pp. 65-73. ISSN 0929-1393.
7. Maksimov, I. V.; Abizgil’dina, R. R. y Pusenkova, L. I. Plant growth promoting
rhizobacteria as alternative to chemical crop protectors from pathogens (Review).
Appl Biochem Microbiol., 2011, vol. 47, pp. 333-345. ISSN 1608-3024.
8. Takahashi, K.; Hayashi, K. I. y Kinoshita, T. Auxin activates the plasma
membrane H+-ATPase by phosphorylation during hypocotyl elongation in Arabidopsis.
Plant physiology, 2012, vol. 159, no. 2, pp. 632-641. ISSN 1532-2548.
9. Desbrosses, G.; Contesto, C. y Varoquaux, F. PGPR-Arabidopsis interactions
is a useful system to study signalling pathways involved in plant developmental
control. Plant Signal Behav., 2009, vol. 4, pp. 321-323. ISSN 1559-2324.
10. Nápoles, M. C.; Martínez, J.; Costales, D. /et al./. Avances en la reidentificación
de la cepa ICA 8001 (Bradyrhizobium japonicum) como perteneciente a Bradyrhizobium
elkanii. Revista Biología, 2006, vol. 20, no. 1-2, pp. 43-46. ISSN 1336-9563.
11. Vincent, J. M. A manual for the practical study of root-nodule bacteria
/J. M. Vincent. En: International Programme Handbook. No. 15. Blackwele scientific
publications, Oxford, England, 1970.
12. Verma, V.; Joshi, K. y Mazumdar, B. Study of Siderophore Formation in Nodule-Forming
Bacterial Species. Research Journal of Chemical Sciences, 2012, vol. 2, no.
11, pp. 26-29. ISSN 2231-606X.
13. Aguado, G. A.; Moreno, B.; Jiménez, B. /et al./. Impacto de los sideróforos
microbianos en la asimilación del hierro por las plantas: una síntesis. Rev.
Fitotec. Mex., 2012, vol. 35, no. 1, pp. 9-21. ISSN 0187-7380.
14. Salkowski, E. Über das verhalten der skatolcarbonsäure im organismus. Physiol
Chem., 1885, vol. 9, pp. 23-33. DOI: 10.1515/bchm1.885.9.1.23.
15. Sambrook, J.; Fritsch, E. F. y Maniatis, T. Molecular Cloning. En: Crimi,
M. y Cremonese, G. Molecular Biology. 2nd Ed. New York : Plainview: Cold Spring
Harbor Lab. 1989. pp. 3-5.
16. Penrose, D. M. y Glick, B. R. Methods for isolating and characterizing ACC
deaminase containing plant growth-promoting rhizobacteria. Physiol. Plant.,
2003, vol. 118, pp. 10-15. ISSN 0031-9317.
17. Bradford, M. M. A Rapid and Sensitive Method for the Quantitation of Microgram
Quantities of Protein Utilizing the Principle of Protein-Dye Binding. Anal.
Biochem., 1976, vol. 72, pp. 248-254. ISSN 0003-2697.
18. Sigarroa, A. Biometría y Diseño Experimental. Primera parte. Editorial Pueblo
y Educación. Ciudad de La Habana, Cuba, 1985. pp. 319-328.
19. Pooja, A. Molecular identification of root nodule bacteria from Cicer arietinum.
Research Journal of Biotechnology, 2012, vol. 7, no. 1, pp. 73-79. ISSN 2278-4535.
20. Bhattacharya, A. Siderophore mediated metal uptake by Pseudomonas fluorescens
and its comparison to iron (III) quelation. Cey. J. Sci. Bio. Sci., 2010, vol.
39, no. 2, pp. 147-155. ISSN 0069-2379.
21. Wright, W. H. Isolation and Identification of the Siderophore "Vicibactin"
Produced by Rhizobium leguminosarum ATCC 14479. J. Sci. Bio. Sci., 2010, vol.
40, no. 1, pp. 157-160. DOI: 10.1007/s10534-013-9609-3.
22. Brear, E. M.; Day, D. A. y Smith, P. M. C. Iron: an essential micronutrient
for the legume-rhizobium symbiosis. Front Plant Sci., 2013, vol. 4, no. 359,
pp. 1-15. ISSN 1664-462X.
23. Kobayashi, T. y Nishizawa, N. K. Iron uptake, translocation, and regulation
in higher plants. Annual review of plant biology, 2012, vol. 63, pp. 131-152.
ISSN 1543-5008.
24. Battistoni, F.; Platero, R.; Noya, F. /et al./. Intracellular Fe content
in?uences nodulation competitiveness of Sinorhizobium meliloti strains as inocula
of alfalfa. Soil Biol. Biochem., 2002, vol. 34, pp. 593-597. ISSN 0038-0717.
25. Dubler, M. R.; Sacool da Sá, E. L.; Goulart, R. /et al./. Caracterización
e influencia de rizobios aislados de alfalfa en la geminación y crecimiento
de plántulas de arroz. Ciencia Rural, Santa María, 2011, vol. 41, no. 10, pp.
1738-1743. ISSN 0103-8478.
26. Kumar, P.; Saha, P.; Mayilraj, S. /et al./. Role of IAA metabolizing enzymes
on production of IAA in root, nodule of Cajanus cajan and its PGP Rhizobium
sp. Biocatalysis and Agricultural Biotechnology, 2013, vol. 2, no. 3, pp. 234-239.
ISSN 1878-8181.
27. Patten, C. L.; Blakney, A. J. y Coulson, T. J. Activity, distribution and
function of indole-3-acetic acid biosynthetic pathways in bacteria. Critical
reviews in microbiology, 2013, vol. 39, no. 4, pp. 395-415. ISSN 1549-7828.
28. Princen, E.; Costacurta, A.; Michiels, K.; Vanserleyden, J. y Van Onckelen,
H. Azospirillum basilence indile-3-acetic acid biosyntesis: evidence for a non-tryptophan
dependent pathway. Mol Plant-Microb Interect, 1993, vol. 6, pp. 609-615. ISSN
0894-0282.
29. Merzaeva, O. V. y Shirokikh, I. G. The production of auxins by the endophytic
bacteria of winter rye. Appilied Biochemistry and Microbiology, 2010, vol. 46,
no. 1, pp. 44-50. ISSN 1608-3024.
30. Donati, A. J.; Lee, H. I.; Leveau, J. H. J. /et al./. Effects of Indole-3-Acetic
Acid on the Transcriptional Activities and Stress Tolerance of Bradyrhizobium
japonicum. PLoS ONE., 2013, vol. 8, no. 10, pp. 1-11. ISSN 1932-6203.
31. Kumar, P. G.; Saha, P.; Mayilraj, S. /et al./. Role of IAA metabolizing
enzymes on production of IAA in root, nodule of Cajanus cajan and its PGP Rhizobium
sp Original. Biocatalysis and Agricultural Biotechnology, 2013, no. 3, pp. 234-239.
ISSN 1878-8181.
32. Kaneshiro, T. y Kwoleck, W. Stimulated nodulation of soybean by Rhizobium
japonicum mutant (B-14075) that catabolizes the conversion of tryptophan to
indol-3yl-acetic acid. Plant Sci., 1985, vol. 42, pp. 141-146. ISSN 0168-9452.
33. Fukuhara, H.; Minakawa, Y.; Akao, S. /et al./. The involvement of indole-3-acetic
acid produced by Bradyrhizobium elkanii in nodule formation. Plant Cell Physiol.,
1994, vol. 35, pp. 1261-1265. ISSN 471-9053.
34. Esquivel, R.; Gavilanes, M.; Cruz, R. /et al./. Importancia agrobiotecnológica
de la enzima ACC desaminasa en rizobacterias, una revisión. Rev. Fitotec. Mex.,
2013, vol. 36, no. 13, pp. 251-258. ISSN 0187-7380.
35. Glick, B. R; Todorovic, B.; Czarny, J. /et al./. Promotion of plant growth
by bacterial ACC deaminase. Rev. Plant Sci., 2007, vol. 26, pp. 227-242. ISSN
0735-2689.
36. Conforte, V. P.; Echeverria, M.; Sánchez, C. /et al./. Engineered ACC deaminase-expressing
free-living cells of Mesorhizobium loti show increased nodulation efficiency
and competitiveness on Lotus spp. J. Gen. Appl. Microbiol, 2010, vol. 54, no.
4, pp. 331-338. ISSN 1349-8037.
37. Sharma, D.; Chauhan, S.; Kumar, G. /et al./. Cadmium stabilization by plant
growth promotory fluorescent pseudomonas in combination with Indian mustard
var. Kranti, South Asean. J. Exptl. Biol., 2012, vol. 3, no. 2, pp. 128-135.
ISSN 1477-9129.
38. Glick, B. R. Modulation of plant ethylene levels by the bacterial enzyme
ACC deaminase. FEMS Microbiol., 2005, vol. 251, pp. 1-7. ISSN 1465-2080.
39. Glick, B. Bacteria with ACC deaminase can promote plant growth and help
to feed the world. Special Issue on Plant Growth Promotion, 2014, vol. 169,
no. 1, pp. 30-39. ISSN 1435-8107.
40. Acebo, Y.; Hernández, A.; Rives, N. /et al./. Perspectivas del uso de bacterias
rizosféricas en el control de Pyricularia grisea (CookeSacc.) en el cultivo
del arroz (Oryza sativa L.). Rev Colomb Biotecnol, 2011, vol. 13, no. 1, pp.
16-22. ISSN 1909-8758.
41. Hernández, A.; Rives, N.; Acebo, Y. /et al./. Potencialidades de las bacterias
diazotróficas asociativas en la promoción del crecimiento vegetal y el control
de Pyricularia oryzae (Sacc.) en el cultivo del arroz (Oryza sativa L.). Rev.
Protección Veg., 2014, vol. 29, no. 1, pp. 1-10. ISSN 2224-4697.
42. Hernández, A.; Heydrich, M.; Diallo, B. /et al./. Cell-free culture medium
of Burkholderia cepacia improves seed germination and seedling growth in maize
(Zea mays) and rice (Oryza sativa). Plant Growth Regul., 2010, vol. 60, pp.
191-197. ISSN 1573-5087.
43. Hontzeas, N. J.; Zoidakis, B. R.; Glick, M. M. /et al./. Expression and
characterization of 1-aminocyclopropane-1-carboxylate deaminase from rhizobacterium
Pseudomonas putida UW4: a key enzyme in bacterial plant growth promotion. Bioch.
Biophys., 2004, vol. 1703, pp. 11-19. ISSN 0006-291X.
Recibido: 3 de
abril de 2014
Aceptado: 28 de agosto de 2014
Ionel Hernández Forte, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas. Mayabeque, CP 32700, Cuba. Email: ionel@inca.edu.cu