COMUNICACIÓN CORTA
Efecto
del Bioenraiz® como estimulante de la germinación y el desarrollo de plántulas
de cafeto (Coffea arabica L.)
Effect of Bioenraiz® as stimulant of coffee plants (Coffea arabica L.) germination and the development
Dra.C. María E. González Vega,I Pedro Rosales Jenqui,I Ms.C. Yanelis Castilla Valdés,I Ms.C. José Á. Lacerra Espino,II Ms.C. Merardo Ferrer VivaII
IInstituto
Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas,
Mayabeque, Cuba. CP 32700.
IIEstación Experimental Agroforestal de Jibacoa, Rincón Naranjo,
Jibacoa, Manicaragua. Villa Clara, CP 54590, Cuba.
RESUMEN
El empleo de métodos biotecnológicos para la obtención de productos eficientes, a partir de bacterias con propiedades benéficas, representa una alternativa de interés para el desarrollo de cultivos de importancia económica en el contexto de una agricultura sostenible. Se estudió el efecto del Bioenraiz®, con propiedades auxínicas que estimulan la germinación y el crecimiento vegetal, durante el proceso de obtención de plántulas de cafeto del cultivar “Caturra rojo” (Coffea arabica L.). Los tratamientos consistieron en estudiar tres concentraciones del biopreparado: 200, 220 y 230 mL L-1 y un control. Se realizaron dos aplicaciones una antes de la siembra de las semillas a través de la imbibición por 20 min y cuando las plantas alcanzaron el primer par de hojas. Se evaluó la germinación a los 50 y 60 días después de la siembra. A los siete meses se evaluó la altura, diámetro del tallo, pares de hojas y masa seca. Se evidenciaron diferencias en la respuesta a la germinación para ambos períodos, el mejor tratamiento fue el de 200 mL L-1 de Bioenraiz®, obteniéndose 79,4 y 94,5 % a los 50 y 60 días después de la siembra, respectivamente. Las semillas tratadas con el biopreparado originaron plántulas que mostraron diferencias significativas y superaron los resultados mostrados por el control para las variables evaluadas, efecto favorable que se atribuye a la composición química del bioproducto. Se contribuye, desde el punto de vista económico, a la recuperación de la caficultura cubana, logrando material de plantación con productos naturales y la calidad requerida.
Palabras clave: café, reguladores del crecimiento vegetal, auxinas, germinación.
ABSTRACT
Biotechnological methods for obtaining of efficient products, from bacterias with beneficent properties, represent an alternative of interest for the development of economical important crops in the context of a sustainable agriculture. The effect of Bioenraiz® in germination and plants growth during the process of plants coffee obtaining of “Caturra rojo” (Coffea arabica L.) was studied. Three concentrations of the biopreparation: 200, 220 and 230 mL L-1 and a Control were evaluated. The application was carried out before the inoculation of the seeds through the imbibitions for 20 min and when the first pair of leaves was reached. The germination was evaluated 50 and 60 days after the inoculation. The height, diameter of shaft, pair of leaves and dry mass were evaluated to the seven months. Differences in the answer to the germination for both periods were evidenced, the best treatment was that of 200 mL L-1 of Bioenraiz®, where 79,4 and 94,5 %, respectively were obtained. Seeds treated with the biopreparation originated plants that showed significant differences with the control for the evaluated variables, effect that is attributed to the chemical composition of the biopreparation that is characterized by not causing adverse alterations in the ecological environment. The results contributed from the economic point of view, to the recovery of coffee in Cuba, achieving plantation material with natural products and the required quality.
Key words: coffee, plant growth regulators, auxins, germination.
INTRODUCCIÓN
El cultivo del
cafeto (Coffea spp.), es reconocido internacionalmente, en la actualidad existen
más de 80 países que producen café, distribuidos en América, África, Asia, Oceanía
y Europa (1). En Cuba, este cultivo constituye una prioridad del sector agrícola,
por ser una bebida de consumo habitual por parte de la población y porque es
un producto exportable, lo que contribuye a incrementar las fuentes de divisas
para el desarrollo económico y social del paísA,B.
La mayor parte del café que se consume en el mundo proviene de la especie Coffea
arabica L., por lo que es la más cultivada, a la que corresponde aproximadamente
el 70 % de la producción mundial (2, 3). Esto se atribuye a la calidad de su
bebida, las características aromáticas y el bajo nivel de cafeína presente en
sus granos.
Es de destacar que a partir del año 2009, se reinició la recuperación de la
producción cafetalera en el país, pero a pesar de esto, las cifras de producción
no satisfacen actualmente el consumo interno ni la exportación, pues al cierre
de la campaña 2012 solo se produjeron 7 100 toneladas (4). Es por ello que se
han introducido diversas estrategias para mejorar los procesos de fomento y
desarrollo del cafeto; dentro de ello se requiere incrementar las áreas dedicadas
al cultivo, así como la disponibilidad de material de plantación para los productores,
donde la obtención de plántulas de calidad juega un papel esencialA (5).
La utilización de semillas de café de alta calidad fisiológica es considerada
como uno de los principales factores que influye en la obtención de plántulas
más vigorosas en condiciones de campo, resultando en mayor productividad del
cultivo (6, 7). El mantenimiento de la calidad de las semillas de cafeto durante
su conservación es, a su vez, una de las principales preocupaciones de especialistas
y productores (8), considerando que pierden rápidamente su viabilidad y con
ello disminuyen los índices de germinación (9).
Por esta razón, la búsqueda constante de vías que favorezcan la producción de
plántulas y el crecimiento productivo en este cultivo, dentro de los que cabe
mencionar la articulación entre métodos convencionales y novedosas técnicas
(10, 11, 12, 13), garantizan la conservación eficiente del germoplasma y permiten
obtener, entre otros aspectos, adecuados niveles de germinación de las semillas,
así como un eficiente desarrollo de las plántulas durante el proceso de obtención
de material de plantación (5, 14).
En este sentido, es conocido que la obtención de productos eficientes, a partir
de bacterias con propiedades benéficas, representa una alternativa de gran interés
(15, 16, 17), y en especial para el desarrollo de cultivos de importancia económica
en el contexto de una agricultura sustentable (18, 19, 20). Estos bioproductos
contribuyen de manera más efectiva a la supervivencia y crecimiento de los cultivos,
pues reducen los efectos negativos del estrés asociado a la nutrición, las relaciones
con el agua, la estructura del suelo, el pH, los metales pesados y los patógenos
(21, 22, 23, 24, 25).
Investigaciones recientes apuntan al Bioenraiz®, obtenido a partir
de una cepa de Rhizobium sp., como nuevo bioproducto regulador del crecimiento
vegetal, debido a evidencias científicas que muestran que dada su composición
química a base de auxinas, juega un importante papel en la germinación de semillas
y posterior desarrollo de las plántulas (26).
En los últimos años se han incrementado las investigaciones y estudios básicos,
a fin de esclarecer el papel biológico de este producto en determinadas especies
vegetales, así como su relación con el crecimiento y desarrollo de plantas,
y su empleo para mejorar la calidad de diferentes procesos. No obstante, el
efecto del Bioenraiz®, al ser aplicado exógenamente, sobre diferentes etapas
del crecimiento de plántulas resulta escasa, por lo que el presente trabajo
tuvo como objetivo evaluar el efecto de este biopreparado durante la obtención
de plántulas de cafeto (C. arabica cv. “Caturra rojo”).
MATERIALES Y MÉTODOS
Los experimentos
se desarrollaron en el Departamento de Genética y Mejoramiento de las Plantas
del Instituto Nacional de Ciencias Agrícolas (INCA), durante el período comprendido
desde noviembre de 2011 hasta junio del 2012.
La siembra se efectuó en bolsas de polietileno (14 x 22 cm), a razón de dos
semillas por bolsa del cultivar “Caturra rojo” de Coffea arabica L., en buen
estado fitosanitario. Se utilizó un suelo Ferralítico Rojo lixiviado (27), el
que fue mezclado con materia orgánica en proporción 3:1 (v:v).
Se estudió el efecto del Bioenraiz®, producto formulado a base de auxinas y
obtenido a partir de una cepa de Rhizobium sp., aislada de ambiente natural,
en los laboratorios del Instituto de Investigaciones de los Derivados de la
Caña de Azúcar (ICIDCA). El bioproducto utilizado en la investigación no provoca
alteraciones adversas en el entorno ecológico.
Se utilizó un diseño de bloques al azar con cuatro tratamientos y tres réplicas,
cada uno estuvo compuesto por 30 bolsas. Los tratamientos ensayados consistieron
en evaluar la efectividad de diferentes concentraciones y momentos de aplicación
del biopreparado Bioenraiz®, para ello se definió un control (agua
destilada) y tres concentraciones del bioproducto: Tratamiento 1-100 mL L-1,
Tratamiento 2-200 mL L-1 y Tratamiento 3-230 mL L-1. La
primera aplicación se realizó antes de la siembra de las semillas, a través
de la imbibición de las mismas en cada una de las soluciones establecidas, por
un período de 20 minutos; posterior al tratamiento las semillas fueron secadas
a la sombra y se procedió a su inoculación. La segunda aplicación del biopreparado
se efectuó cuando las plantas presentaban el primer par de hojas, a razón de
10 mL por planta.
La germinación fue evaluada a los 50 y 60 días posteriores a la siembra. A los
siete meses de realizada la siembra se evaluó altura (cm), diámetro del tallo
(cm), pares de hojas y masa seca (g), en las plántulas que fueron asperjadas
al contar con el primer par de hojas y en las no tratadas, para cada uno de
los tratamientos en estudio. Los datos experimentales se procesaron estadísticamente
mediante un análisis de varianza de clasificación doble para p<0,05, y las
medias se compararon por la prueba de comparación de rangos múltiples de Duncan,
con una previa transformación de los datos, según la expresión arcsen, usando
el paquete SAS 9.0.
RESULTADOS Y DISCUSIÓN
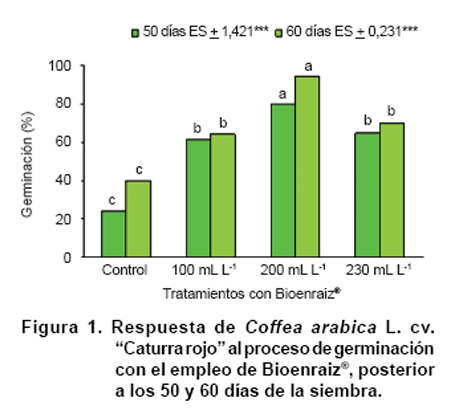
Al analizar el comportamiento de la germinación de las semillas de cafeto a los 50 y 60 días después de la siembra, se observó que Bioenraiz® tuvo un efecto significativo sobre dicho proceso (Figura 1). Efecto atribuible a que los reguladores del crecimiento, o sea sustancias químicas tanto de origen natural como sintéticas, tienen efectos biológicos sobre la germinación de semillas y estimulación del sistema radical (28, 29, 30).

La aplicación de
200 mL L-1 del biopreparado, permitió obtener los mejores resultados,
valores que se diferencian significativamente de los resultados obtenidos con
el resto de los tratamientos y oscilaron entre 79,4 y 94,5 % de germinación
para los 50 y 60 días, respectivamente. Es de destacar, que la respuesta de
un determinado tejido u órgano vegetal a auxinas está en correspondencia con
la concentración de este regulador del crecimiento y la sensibilidad al mismo.
Es importante señalar que aunque las otras dos concentraciones de Bioenraiz®
arrojaron valores de germinación inferiores, estos superaron a lo logrado con
el control para ambas fechas de evaluación. Al parecer, concentraciones inferiores
o superiores a 200 mL L-1 de Bioenraiz®, resultaron menos
efectivas para la estimulación de la germinación en el cultivar de cafeto “Caturra
rojo”, apreciándose un decrecimiento para este indicador, quizás dado los niveles
endógenos de compuestos auxínicos, ya que generalmente la respuesta a las prácticas
de aplicación exógena de los mismos, está en correspondencia con la influencia
de diversos factores, entre ellos, la disponibilidad a nivel intracelular en
forma libre o conjugada (31).
Además, se evidenció un crecimiento anormal en algunas plántulas procedentes
de semillas tratadas con la concentración más elevada del biopreparado, así
como una fuerte inhibición del proceso de formación de hojas verdaderas. Este
comportamiento pudiera atribuirse al hecho de que Bioenraiz® está
compuesto mayoritariamente por índoles, tales como, el ácido indol acético (AIA),
ácido indol butírico (AIB) y ácido indol propiónico (AIP), todos con propiedades
auxínicas. Los reguladores del crecimiento vegetal actúan a muy bajas concentraciones
en los procesos fisiológicos de las plantas, y cuando no se aplican los niveles
requeridos, se pueden inducir alteraciones fisiológicas, que a su vez, pueden
causar cambios morfológicos de significación (32).
La disponibilidad de auxinas en los tejidos vegetales puede regularse a través
de su tasa de síntesis, la velocidad de transporte entre órganos y los diferentes
mecanismos de desactivación, dentro de ellos, la conjugación con otras moléculas
como azúcares o aminoácidos (33). Algunos estudios evidencian la presencia de
conjugados auxínicos, detectados en semillas y plántulas como tal (34), siendo
estos conjugados reversibles, a diferencia de la degradación que sí constituye
un proceso irreversible.
Estos aspectos corroboran la relación entre el metabolismo y el mecanismo de
acción hormonal en plantas, implicado directamente en todas las fases de desarrollo
y de manera muy especial en la fase inicial de germinación de las semillas y
la formación de plántulas (35).
Diversas investigaciones demuestran la producción de sustancias con efecto regulador
del crecimiento vegetal por parte de bacterias y su impacto en diferentes procesos
asociados al desarrollo y crecimiento de plantas (17, 18, 19, 36). En este sentido,
la necesidad de desarrollar estudios que faciliten la selección y el empleo
de las dosis adecuadas de estos productos, según los objetivos que se persiguen
en cuanto a procesos a inducir y al cultivo en cuestión, ya que son repuestas
que en gran medida están en correspondencia con la especie y el estado fisiológico
de la planta.
Por otra parte, los resultados evidencian que el Bioenraiz® tuvo
un efecto significativo sobre el desarrollo de las plántulas de cafeto tratadas
con concentraciones entre 200 y 230 mL L-1, obteniéndose diferencias
significativas con respecto al control para las variables altura, diámetro del
tallo, número de pares de hojas y masa seca foliar (Tablas
I y II).

Es de destacar, que cuando el biopreparado se aplicó solo como tratamiento pregerminativo,
las concentraciones de 200 y 230 mL L-1 indujeron valores sin diferencias
significativas, para las variables analizadas, exceptuando la masa seca foliar;
aunque este aspecto es de interés pues es conocido que la masa seca refleja
el rendimiento biológico del vegetal. Dicho efecto pudiera estar dado por el
papel favorable de las auxinas, en concentraciones adecuadas y de forma activa,
lo que a su vez depende del nivel de síntesis y aplicación, transporte, degradación
y compartimentación, e incide en la formación de pelos radicales y el número
y elongación de raíces laterales, facilitando la absorción de agua y nutrientes
por la planta, así como un mayor intercambio con el medio ambiente de la rizosfera
(29). Se plantea que al ejercer las auxinas acción positiva sobre estos procesos
relacionados con el sistema radical, provocan la reducción de la presión de
la pared e inducen la síntesis de enzimas específicas, lo que conlleva al aumento
de la plasticidad de la pared celular y favorece la germinación.
Este comportamiento se relaciona con la respuesta a la bioestimulación, informada
para otros cultivares de cafeto, al utilizar microorganismos rizosféricos o
productos derivados de estos en la obtención de posturas. Así pudiera citarse
el uso de Azotobacter en clones de Coffea canephora P., en los que se obtuvieron
resultados favorables en la fase de vivero (37). En este mismo sentido, al emplear
el bioestimulante Azotobacter chroococcum, pero en posturas de la especie Coffea
arabica L., se obtuvo mejor comportamiento al realizar la aplicación en el momento
del trasplante y en el primer par de hojas.
Asimismo, al emplear un biopreparado de origen bacteriano a partir de Burkholderia
cepacia Palleroni y Holme, durante las fases de crecimiento y desarrollo de
plántulas de cafeto de Coffea canephora P. cv. Robusta, se obtuvieron resultados
favorables para los indicadores número de pares de hojas, altura de la planta
y masa seca (38). De igual modo, han sido informadas respuestas positivas en
diferentes cultivos como arroz (Oryza sativa) y maíz (Zea mays) al emplear bioproductos
obtenidos a partir de otras especies de bacterias estimulantes del crecimiento
vegetal (19, 36).
Los resultados con la concentración más baja de Bioenraiz® al aplicarlo
durante la germinación evidenciaron valores que no se diferenciaron de lo alcanzado
en el control, para los indicadores altura de la planta y masa seca foliar;
sin embargo, esta concentración indujo mayor diámetro del tallo y elevó el número
de pares de hojas para el cultivar en estudio con respecto al control (Tabla
I).
La utilización del biopreparado, a través de la aspersión foliar a razón de
10 mL por planta, cuando las plántulas alcanzaron el primer par de hojas, repercutió
favorablemente en el desarrollo morfológico de las mismas (Tabla
II), o sea los valores obtenidos para los indicadores del crecimiento superaron
no solo al tratamiento control, sino también a los alcanzados cuando el Bioenraiz®
se aplicó solamente durante la etapa de germinación.
En este caso el tratamiento con 200 mL L-1 resultó ser el más efectivo
para todos los indicadores evaluados. En la Figura 2 se observa
el estado favorable de plántulas procedentes de semillas tratadas con 200 mL
L-1 de Bioenraiz® y asperjadas foliarmente, cuando presentaron el
primer par de hojas. Las mismas se caracterizaron por presentar adecuado vigor
y hojas de coloración verde brillante. El biopreparado a base de componentes
auxínicos aplicado exógenamente sobre las hojas puede penetrar en los elementos
cribosos después de ser absorbido y transportarse al parénquima vascular (39).

En
la Tabla II se aprecia
cierto efecto depresivo para las variables evaluadas con la aplicación de Bioenraiz®,
después de la emisión del primer par de hojas, al utilizar la concentración
del biopreparado más elevada (230 mL L-1). Aspectos que corroboran
que el incremento de la concentración del bioproducto puede inhibir algunos
aspectos del metabolismo o determinadas fases del proceso de crecimiento y desarrollo
en este cultivo. La cantidad de compuestos auxínicos presentes en hojas depende
de la edad de estos tejidos, aunque se plantea que los tejidos jóvenes resultan
más eficientes (33). En este caso, para diámetro del tallo se alcanzaron valores
que aunque menores de los obtenidos con 200 mL L-1 del biopreparado,
superaron al control.
En este sentido, estudios precedentes corroboran las potencialidades de diversos
géneros bacterianos (36, 37), así como efectos beneficiosos del tratamiento
con biopreparados obtenidos a partir de los mismos (19, 38), en diferentes estados
físicos y fisiológicos de los microorganismos; y utilizando diversas formas
de aplicación sobre índices morfofisiológicos de plántulas de cafeto (6, 14,
37, 38), apreciándose mayor crecimiento y porcentaje de supervivencia en las
plantas tratadas. Dichos efectos se atribuyen al aporte de sustancias bioestimuladoras
del crecimiento, tales como auxinas, citoquininas, giberelinas, aminoácidos
y vitaminas, que permiten la aceleración del desarrollo en plantas (18).
Estos comportamientos indican la respuesta favorable del material vegetal a
la bioestimulación, y que la efectividad de los tratamientos con biopreparados
de origen bacteriano está en dependencia de la concentración de los mismos,
la especie, cultivar o genotipo en estudio y el momento y forma de aplicación.
Dado que el uso indiscriminado de productos químicos constituye una de las principales
causas de los grandes trastornos ecológicos en los agroecosistemas, en los últimos
años se ha incrementado el interés en el campo de la microbiología. Con el empleo
de productos de origen biológico en la agricultura se estimula el rendimiento
de las plantas y la productividad de los cultivos, sustituyendo sustancias químicas
contaminantes del medio (23, 40). Los resultados obtenidos en este trabajo son
de importancia por su posible impacto económico y medioambiental, al tener en
consideración las características y los efectos favorables del producto Bioenraiz®.
De forma general, esta alternativa pudiera contribuir a la obtención de material
de plantación de cafeto de óptima calidad y de forma rentable, con una significativa
disminución del uso de productos químicos, lo que propicia el ahorro de recursos,
el mejoramiento de suelos, así como el cuidado del medio ambiente, lo que constituye
una práctica factible de incluir en el manejo integrado del cultivo del cafeto.
CONCLUSIONES
La aplicación de 200 mL L-1 de Bioenraiz®, logró estimular
la germinación de semillas de cafeto (Coffea arabica L. cultivar “Caturra rojo”)
a los 50 días con 79,4 % y a los 60 días con 94,5 %, porcentajes que superaron
a lo obtenido con el resto de los tratamientos.
Las plantas procedentes de semillas tratadas con Bioenraiz®, después
de siete meses de cultivo, para las diferentes variables evaluadas alcanzaron
valores numéricos y estadísticos que superaron al control, por lo que se pudiera
recomendar esta práctica para la producción masiva de plantas, ya que garantiza
la supervivencia al transplante.
BIBLIOGRAFÍA
1. Mishra, K.
y Slater, A. Recent Advances in the Genetic Transformation of Coffee. Biotechnology
Research Internacional, 2012, vol. 2012, Article ID 580857. 17 pp. [Consultado:
enero 2013]. Disponible en: <http://dx.doi.org/10.1155/2012/580857>.
2. Mondego, J.; Vidal, R.; Carrazole, M.; Tokuda, E.; Parizzi,
G.; Pereira, L.; Andrade, A.; Colombo, C.; Vieira, L. y Pereira, G. An EST-based
analysis identifies new genes and reveals distinctive gene expression features
of Coffea arabica and Coffea canephora. BMC Plant Biology, 2011, feb. 8, no.
11, 30 pp. doi: 10.1186/1471-2229-11-30.
3. López, P.; Irachaeta, L.; Juárez, M.; Méndez, I.; Esquivez,
A.; Aguirre, J.; Ojeda, M. y Gutiérrez, A. Influencia del explante y medio de
cultivo en la embriogénesis somática en hojas de café. Revista Fitotecnia Mex.,
2010, vol. 33, no. 3, pp. 205-213. ISSN 0187-7380.
4. Nicola, M. y Camacho, L. Acometen programa recuperativo en
el café y el cacao. Periódico juventud rebelde. 2012. p. 3. [Consultado: enero
2012]. Disponible en: <http://www.juventudrebelde.cu/cuba/2012-06-13/>.
5. Isaac, E.; Ferrer, A. y Fung, Y. Efecto de la aplicación de
un campo electromagnético sobre el contenido de proteínas solubles y carbohidratos
de embriones cigóticos de Coffea arabica L. cultivados in vitro. Biotecnología
Vegetal, 2010, vol. 10, no. 1, pp. 53-56. ISSN 2074-8647.
6. Arizaleta, M.; Montilla, J. y Pares, J. Efecto del almacenamiento
de las semillas de cafeto (Coffea arabica L. var. Catuai amarillo) sobre la
emergencia. Revista de la Facultad de Agronomía, 2005, vol. 22, no. 3, pp. 205-213.
ISSN 0378-781.
7. Eira, M. T. S.; Amaral da Silva, E. A.; De Castro, R.; Dussert,
S.; Walters, Ch.; Derek, J. y Hilhorst, H. W. M. Coffee seed physiology. Brazilian
Journal of Plant Phisiology, 2006, vol. 18, no. 1, pp. 149-163. ISSN 1677-0420.
8. Davis, A. P. y Gole, T. W. Wild coffee species-diversity,
use, and conservation. Coffee and Cocoa International, 2011, vol. 37, no. 6,
pp. 24-27. ISSN 0262-5938.
9. Castilla, Y. Conservation of phytogenetic resources of coffee-tree
(Coffea spp.) by biotechnological methods: an alternative to its preservation.
Cultivos Tropicales, 2012, vol. 33, no. 4, pp. 29-39. ISSN 1819-4087.
10. Cruz, F. S.; Kalaoun, P.; Nobile, C.; Colombo, J.; Almeida,
L.; Barros, E.; Romano, M.; Grossi-de-Sa, M. y Alves-Ferreira, M. Evaluation
of coffee reference genes for relative expresión studies by quantitative real-time
RT-PCR. Mol Breeding, 2009, no. 23, pp. 607- 616. ISSN 1572-9788.
11. Marracinni, P.; Freire, L.; Alves, G.; Vieira, N.; Vinecky,
F.; Elbelt, S.; Ramos, H.; Montagnon, C.; Vieira, L. y Andrade, A. RBCS1 expression
in coffee: Coffea orthologs, Coffea arabica homeologs, and expresión variability
between genotypes and under drought stress. BMC Plant Biology, 2011, vol. 11,
no. 85, pp. 2-27. ISSN 1471-2229.
12. Barbón, R.; Jiménez, E.; Capote, A.; Gil, V. y Ocaña, B.
Transformación genética de Coffea arabica cv. Caturra rojo mediante la electroporación
de suspensiones celulares embriogénicas. Biotecnología Vegetal, 2011, vol. 11,
no. 1, pp. 33-42. ISSN 2074-8647.
13. Costa, J.; Herrique, C.; Carolina, A.; Pascual, M. y Batista,
J. Multiplication of embryogenic calli in Coffea arabica L. Maringá, 2012, vol.
34, no. 1, pp. 93-98. ISSN 1413-7372.
14. Adriano, M.; Jarquín, R.; Ramos, C.; Salvador, M. y Vargas,
C. Biofertilizer of organic coffee in stage of seedlings in Chiapas, México.
Revista Mexicana de Ciencias Agrícolas, 2011, vol. 2, no. 3, pp. 53-62. ISSN
2007-0934.
15. Thirumala, M.; Vishnuvardhan-Reddy, S. y Mahmood, S. K. Production
and characterization of PHB from two novel strains of Bacillus spp. isolated
from soil and activated sludge. Journal of Industrial Microbiology and Biotechnology,
2010, vol. 37, no. 3, pp. 171-178. ISSN 1367-5435.
16. Baset, M.; Shamssudin, Z.; Wahab, Z. y Marcia, M. Effect
of plant growth promoting rhizobacterial (PGPR) inoculation on growth Ans nitrogen
incorporation of tissue-cultured Musa plantlets under nitrogen-free hydroponics
conditions. Australian Journal of Crop Science, 2010, vol. 4, no. 2, pp. 85-90.
ISSN 1835-2707.
17. Compant, E.; Climent, C. y Sessitsch, A. Plant growth promoting
bacteria in the rhizo and endosphere of plants: Their role, colonization, mechanisms
involved and prospects for utilization. Soil Biology and Biochemestry, 2010,
vol. 42, no. 5, pp. 669-678. ISSN 0038-0717.
18. Adesemoye, A. y Kloepper, J. Plant-microbes interactions
in enhanced fertilizer use efficiency. Applied microbiology and biotechnology,
2009, no. 85, pp. 1-12. ISSN 1432-0614.
19. Hernández-Rodríguez, Annia; Heydrich-Pérez, Mayra; Diallo,
Billo; El Jaziri, Mondher y Vandeputte, Olivier M. Cell-free culture medium
of Burkholderia cepacia improves seed germination and seedling growth in maize
(Zea mays) and rice (Oryza sativa). Plant Growth Regul., 2010, vol. 60, no.
3, pp. 191-197. DOI: 10.1007/s10725-009-9433-5.
20. Lara, C.; García, T. y Oviedo, L. Using a solid waste culture
medium for growing a native strain having biofertiliser potential. Revista Colombiana
de Biotecnología, 2010, vol. 12, no. 1, pp. 103-112. ISSN 1909-8758.
21. Kuffner, M.; Puschenreiter, M.; Wiesshammer, G.; Gorfer,
M. y Sessitsch, A. Rhizosphere bacteria affect growth and metal uptake of heavy
metal accumulating willows. Plant Soil, 2008, no. 304, pp. 35-44. ISSN 1573-5036.
22. Hernández, A.; Heydrich, M.; Acebo, Y.; Velázquez, M. G.
y Hernández, A. N. Antagonistic activity of Cuban native rhizobacteria against
Fusarium verticillioides (Sacc.) Nirenb. in maize (Zea mays L.). Applied Soil
Ecology, 2008, no. 36, pp. 184-189. ISSN 0929-1393.
23. Acebo, Y.; Hernández, A.; Rives, N.; Velázquez, M. G. y Hernández,
A. N. Prospect of the use of bacteria in the control Pyricularia grisea (Cooke
Sacc.) on rice (Oriza sativa L.). Revista Colombiana de Biotecnología, 2011,
vol. 13, no. 1, pp. 16-22. ISSN 1909-8758.
24. Hassan, M. N.; Afgani, S. y Afees, F. Supresión of red rot
caused by Colletotrichum on sugarcane plant using plant growth-promoting rhizobacteria.
Biocontrol, 2010, vol. 55, no. 4, pp. 531-542. ISSN 1573-8248.
25. Ramírez, B.; Arcila, V. y Montoya, R. Estimación de la humedad
del suelo de cafetales a libre exposición. Cenicafé, 2010, vol. 61, no. 3, pp.
251-259. ISSN 0120-0275.
26. Beiro, O.; Echevarría, M. E.; Fraga, R.; Suárez, A.; Domínguez,
J.; Trujillo. A. y Carballo, O. Toxicidad aguda por contacto del Bioenraiz en
abejas (Apis mellifera). Revista de Toxicología, 2007, pp. 39-50. ISSN 1697-0748.
27. Hernández, A.; Pérez, J. M.; Boseh, D. y Rivero, L. Nueva
versión de clasificación genética de los suelos de Cuba. Ministerio de la Agricultura.
Ciudad de la Habana. 1999, 23 pp.
28. Kakani, A.; Li, G. y Peng, Z. Role of AUX1 in the control
of organ identy during in vitro organogenesis and in mediating tissue specific
auxin and cytokinin in interaction in Arabidopsis. Planta, 2009, vol. 229, no.
3, pp. 645-657. ISSN 1432-2048.
29. Rahman, A.; Hosokawa, S.; Oono, Y.; Amakawa, T.; Goto, N.
y Tsurumi, S. Auxin and ethylene response interactions during Arabidopsis root
hair development diss. Plant Physiol., 2012, vol. 130, no. 4, pp. 1908-1917.
ISSN 1532-2548.
30. Amanullaah, M. M.; Sekar, S. y Vincent, S. Plant growth substances
in crop production: A review. Asian Journal of Plant Science, 2010, vol. 9,
pp. 215-222. ISSN 682-3974.
31. Rampey, R.; Leclere, S.; Kowalczyk, M.; Ljung, K.; Sandberg,
G. Y Bartel, B. A family of auxin-conjugate hydrolases that contributes to free
indole-3 acetic acid levels during Arabidopsis germination. Plant Physiology,
2004, no. 135, pp. 978-988. ISSN 1532-2548.
32. Shirani, S.; Mahdavi, F. y Maziah, M. M. Morphological abnormality
among regenerated shoots of banana and plantain (Musa spp.) after in vitro multiplication
with TDZ and BAP from excised shoottips. African Journal of Biotechnology, 2009,
vol. 8, no. 21, pp. 5755-5757. ISSN 1684-5315.
33. Marques, L.; Pascual, M.; Rezende, A.; Barreto, A. y Cavalcante-Alvres,
J. Cultura in vitro de embriões de Coffea arabica: Influência de NAA e BAP.
Ciênc. Agrotec., 2001, vol. 25, no. 5, pp. 1063-1070. ISSN 1413-7054.
34. Staswick, P.; Serban, B.; Rowe, M.; Tiryaki, I.; Maldonado,
M.; Suza, W. Characterization of an Arabidopsis enzyme family that conjugates
amino acids to indole-3 acetic acid. Plant Cell, 2005, no. 17, pp. 616-627.
ISSN 1532-298.
35. Taiz, L. y Zeiger, E. Auxin: The growth hormone. En: Associates,
S. (ed). Plant Physiology. Sinauer Associates. Sunderland, M. A. 2006, pp. 424-460.
36. Pedraza, R.; Teixeira, O.; Fernández, K.; Scavino, A.; García
de Salamone, I.; Baca, B. E.; Azcón, R.; Baldani, O. y Bonilla, R. Microorganismos
que mejoran el crecimiento de las plantas y la calidad de los suelos. Revista
Corpoica - Ciencia y Tecnología Agropecuaria, 2010, vol. 11, no. 2, pp. 155-164.
ISSN 0122-8706.
37. Bustamante, C. A.; Rodríguez, M. I. y Pérez, A. Respuesta
de clones de Coffea canephora a la aplicación de Azotobacter en fase de vivero.
Café Cacao, 2010, vol. 9, no. 1, pp. 8-13. ISSN 1680-7685.
38. González, M. E.; Castilla, Y. y Hernández, A. Obtención de
suspensiones celulares y embriones somáticos de cafeto (Coffea canephora P.),
con el empleo de metabolitos bacterianos. Revista Colombiana de Biotecnología,
2011, vol. 13, no. 1, pp. 123-131. ISSN 1909-8758.
39. Ljung, K.; Hull, A.; Kowalczyk, M.; Marchant, A.; Celenza,
J.; Cohen, J. y Sandberg, G. Biosíntesis, conjugation, catabolism and homeostasis
of indole-3 acetic acid in Arabidopsis thaliana. Plant Molecular Biology, 2002,
no. 50, pp. 309-332. ISSN 1573-5028.
40. Souza Moreira, F. M.; Da Silva, K.; Abrahão Nobrega, R. S.
y De Carvalho, F. Bactérias diazotróficas associativas: diversidade, ecología
e potencial de aplicações. Comunicata Scientiae, 2010, no. 1, pp. 79-99. ISSN
2177-5133.
Recibido: 15 de julio de
2013
Aceptado: 1 de abril de 2014
Dra.C. María E. González Vega, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba. CP 32700. Email: esther@inca.edu.cu