Inducción
de mecanismos de defensa en plantas de tomate (Solanum lycopersicon L.) micorrizadas
frente al ataque de Oidiopsis taurica (Lev.) Salm
Induction
of defense mechanisms in mycorrhized tomato plants against the attack of Oidiopsis
taurica (Lev.) Salm
Dr.C. Eduardo
Pérez Ortega,I Dra.C. Blanca M. de la Noval,I Dr.C. Benedicto
Martínez Coca,II
Dr.C. Walfredo Torres de la Noval,I Aida Medina Carmona,I
Dra.C Annia Hernández,III Ondina LeónII
IInstituto
Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas,
Mayabeque, Cuba. CP 32 700.
IICentro Nacional de Sanidad Agropecuaria (CENSA), Mayabeque, Cuba.
IIIUniversidad de La Habana, Cuba.
RESUMEN
Se realizó un
experimento con el objetivo de evaluar la respuesta del tomate micorrizado,
frente al ataque del hongo fitopatógeno Oidiopsis taurica (Lev.) Salm. Para
ello se enfrentaron plantas previamente tratadas con los hongos micorrízicos
arbusculares (HMA) Glomus cubense (40 esporas g-1) y G. mosseae (60
esporas g-1) con O. taurica (2 x 104 esporas mL-1), a
los 21 días de germinadas. Se determinaron algunas actividades enzimáticas relacionadas
con la inducción de defensa (PRX, PPO, ß-1,3 glucanasa, quitinasa y fenilalanina
amonio liasa), así como variables micorrízicas (densidad visual u ocupación
fungica (D.V) y porcentaje de colonización) y porcentaje de daño producido por
el patógeno. Las especies micorrízicas indujeron respuestas sistémicas en las
plantas, donde los mayores niveles de protección se observaron en las plantas
tratadas con G. cubense. Los niveles de inducción de respuesta no fueron suficientes
para evitar la colonización del hongo fitopatógeno y por ende, el daño producido
por este; sin embargo; existió una respuesta diferencial entre las dos especies
de HMA estudiadas. Es interesante destacar la baja respuesta inducida por G.
mosseae frente al ataque de este hongo fitopatógeno, lo cual permite concluir
que no todos los HMA presentan la misma respuesta inductiva frente a un fitopatógeno
específico.
Palabras
clave: mecanismos de defensa, patogenicidad, tomate, HMA.
ABSTRACT
In order to evaluate
mycorrhized tomato plants against the attack of Oidiopsis taurica pathogen an
experiment was conducted. Plants previously treated with arbuscular mycorrhizal
fungus (AMF) Glomus cubense (40 spores g-1) and G. mosseae (60 spores
g-1) were challenged with O. taurica (2 x 104 spores mL-1),
at 21 days of germination. Several enzymatic activities related to the induction
of defense (PRX, PPO, ß -1.3 glucanase, chitinase and phenylalanine ammonia
lyase) were determined and mycorrhizal variables (visual density or fungal occupation
(DV) and colonization rate) and percentage of damage caused by the pathogen
were measured. Mycorrhizal species induced systemic responses in plants where
higher levels of protection were observed in plants treated with G. cubense.
These levels were not sufficient to prevent colonization of the pathogen and
thus the damage caused by this, however, there was a differential response between
both AMF studied. The low response induced by G. mosseae against the attack
of the plant pathogenic fungus was remarkable, which leads to the conclusion
that not all HMA have the same inductive response against a specific plant pathogen.
Key words:
defense mechanisms, pathogenicity, tomato, AMF.
INTRODUCCIÓN
Es conocida la
tendencia actual a disminuir el uso de plaguicidas de cualquier tipo y, por
tanto, su incidencia negativa sobre el suelo y el hombre (1). El uso de productos
de origen biológico en la agricultura ha alcanzado gran auge en los últimos
años, estimulando el rendimiento de las plantas y la productividad de los cultivos
a través de la producción de biofertilizantes, que sustituyan las sustancias
químicas contaminantes (2).
Teniendo en cuenta esa tendencia los hongos micorrízicos arbusculares (HMA)
han recibido una especial atención en las últimas décadas, primeramente por
encontrarse de manera natural en los ecosistemas y establecer una simbiosis
mutualista con la mayoría de las plantas de interés económico y luego, por influir
positivamente en la nutrición del hospedero, su estado fisiológico y su disposición
para enfrentar el ataque de diversos patógenos (2, 3).
Entre los hongos fitopatógenos que afectan al cultivo de las hortalizas se encuentra
Oidiopsis taurica (Lev.) Salm., causante de la cenicilla polvorienta, cuya incidencia
se ve aumentada por los cambios climáticos que han producido inviernos más cálidos
y húmedos Este patógeno se ve favorecido en condiciones de humedad relativa
del 70 % y temperaturas de entre 10 y 35 °C, con un óptimo a los 25 °C, condiciones
ambientales promedio en las que se desarrollan las hortalizas en nuestro paísA.
Teniendo en cuenta lo antes planteado y considerando que estos HMA se informan
como bioprotectores contra patógenos radicales fundamentalmente (6), y dada
la necesidad de conocer su capacidad bioprotectiva contra patógenos foliares
se realizó este trabajo con el objetivo de evaluar la respuesta de dos especies
de HMA, en plantas de tomate (Solanum lycopersicum, L.), frente al ataque del
hongo fitopatógeno que provoca la cenicilla polvorienta.
MATERIALES
Y MÉTODOS
Los experimentos
fueron desarrollados en las áreas del Centro Nacional de Sanidad Vegetal (CENSA)
y se condujeron utilizando un diseño completamente aleatorizado con tres réplicas
y dos repeticiones. Se seleccionó la variedad de tomate “Amalia” (Solanum lycopersicum,
L.) obtenida por el Departamento de Genética y Mejoramiento del Instituto Nacional
de Ciencias Agrícolas (INCA) (4). El experimento se desarrolló en recipientes
de 1 kg de capacidad, con un sustrato conformado por una mezcla de suelo Ferralítico
Rojo y humus de lombriz en relación 3:1 (v/v), que fue esterilizado por calor
seco a 150 ºC durante una hora por tres días. Algunas características agroquímicas
del sustrato empleado se muestran en la Tabla
I.

Se emplearon las especies de HMA Glomus cubense (Y. Rodr. & Dalpé) (INCAM-4)
(5) y Glomus mosseae (Nicolson & Schenck) (INCAM-2) (6) procedentes del
cepario del Instituto Nacional de Ciencias Agrícolas (INCA), cuyos inóculos
poseían un título de 40 y 60 esporas g-1 de suelo fresco respectivamente,
los que fueron inoculados mediante recubrimiento de semilla y se realizó una
dinámica de establecimiento de la micorrización para las dos cepas desde el
día 3 hasta el día 26.
Se realizó el muestreo para determinar la colonización fúngica en las plantas
no inoculadas con el patógeno, para lo cual se conformó una muestra de raíces
de al menos 10 plantas, tomadas al azar, por tratamiento. Las mismas se secaron
a 70 ºC y fueron teñidas mediante el método descrito por Phillips y Hayman (7),
siendo evaluado el porcentaje de colonización por el método de los interceptos
(Grid line intersect) (8). Se calculó la intensidad de la colonización o Densidad
Visual (% DV) (9).
Se realizaron dos repeticiones del experimento en los años 2003, 2004, durante
el periodo Enero-Marzo por ser la época más propicia para el cultivo. Las plantas
fueron mantenidas en condiciones de casa de cristal hasta el momento de ser
inoculadas con el patógeno en que se ubicaron en casa de malla, donde se les
atenuó la incidencia de los rayos solares, en las áreas del CENSA, San José
de Las Lajas, Mayabeque, Cuba.
El inóculo de O. taurica se colectó de plantas de tomate variedad Amalia infectadas
que se mantenían en condiciones de crecimiento a 20 ± 2 ºC, humedad relativa
de 70 % y fotoperíodo natural. Las esporas frescas se colectaron por lavado
con agua destilada de hojas infectadas para preparar un inóculo cuya concentración
se ajustó a 2 x 104 esporas mL-1 y se asperjaron sobre las hojas
de las plantas de 21 días de edad, a razón de 5 mL. Se emplearon tres réplicas
conformadas cada una por tres plantas, las que fueron mantenidas en cámara húmeda
cerrada (cubiertas con nylon), para favorecer el establecimiento de los patógenos.
Se establecieron
los siguientes tratamientos:
• Plantas control
(sin HMA ni patógenos)
• Plantas micorrizadas con G. mosseae
• Plantas micorrizadas con G. cubense
• Plantas inoculadas con O. taurica
• Plantas micorrizadas con G. mosseae e inoculadas con O. taurica
• Plantas micorrizadas con G. cubense e inoculadas con O. taurica
A los cinco días posteriores a la inoculación se evaluaron los síntomas y signos
de la enfermedad causada por el patógeno y se muestreó para determinaciones
de actividad enzimática, donde el material vegetal fue separado por órganos.
Los datos fueron transformados, según la escala informada por Schaefer et al.
(10) y se analizaron usando la prueba no paramétrica de comparación múltiple
de Kruskal Wallis complementado por la prueba de comparación de Mann-Whitney
y la correspondiente corrección de Bonferroni (11).
Se procedió a la extracción de proteínas por el método descrito por SolórzanoB
y se cuantificó la concentración (19), realizándose la lectura de la absorbancia
a 595 nm en espectrofotómetro (Ultrospec Plus spectophotometer, Pharmacia LKB),
para lo cual se confeccionó una curva patrón de albúmina de suero bovino a partir
de una solución madre de 1 mg mL-1.
Se determinaron las actividades enzimáticas que se muestran en la Tabla
II y se expresaron en Unidades de Actividad Enzimática según la siguiente
expresión:
Actividad Específica (UAE) = Act. Enzimática/ Conc. de proteína

Se calculó el intervalo de confianza de las medias al 95 % de probabilidad,
atendiendo al número de repeticiones y la reproducibilidad de los datos. Se
desarrolló un Análisis Multivariado de Componentes Principales para determinar
las relaciones de los patógenos con las actividades enzimáticas que se reflejan
en las plantas y la severidad de los síntomas. Se utilizó el programa STATGRAPHYCS
Plus, Versión 5.1.de Microsoft®. Los análisis de comparación de medias
y la determinación de los intervalos de confianza fueron realizados por el programa
STATISTIC versión 6.1.
RESULTADOS
Y DISCUSIÓN
La Figura
1 muestra los porcentajes de colonización y ocupación fúngica (% DV) para
cada uno de los tratamientos en estudio.
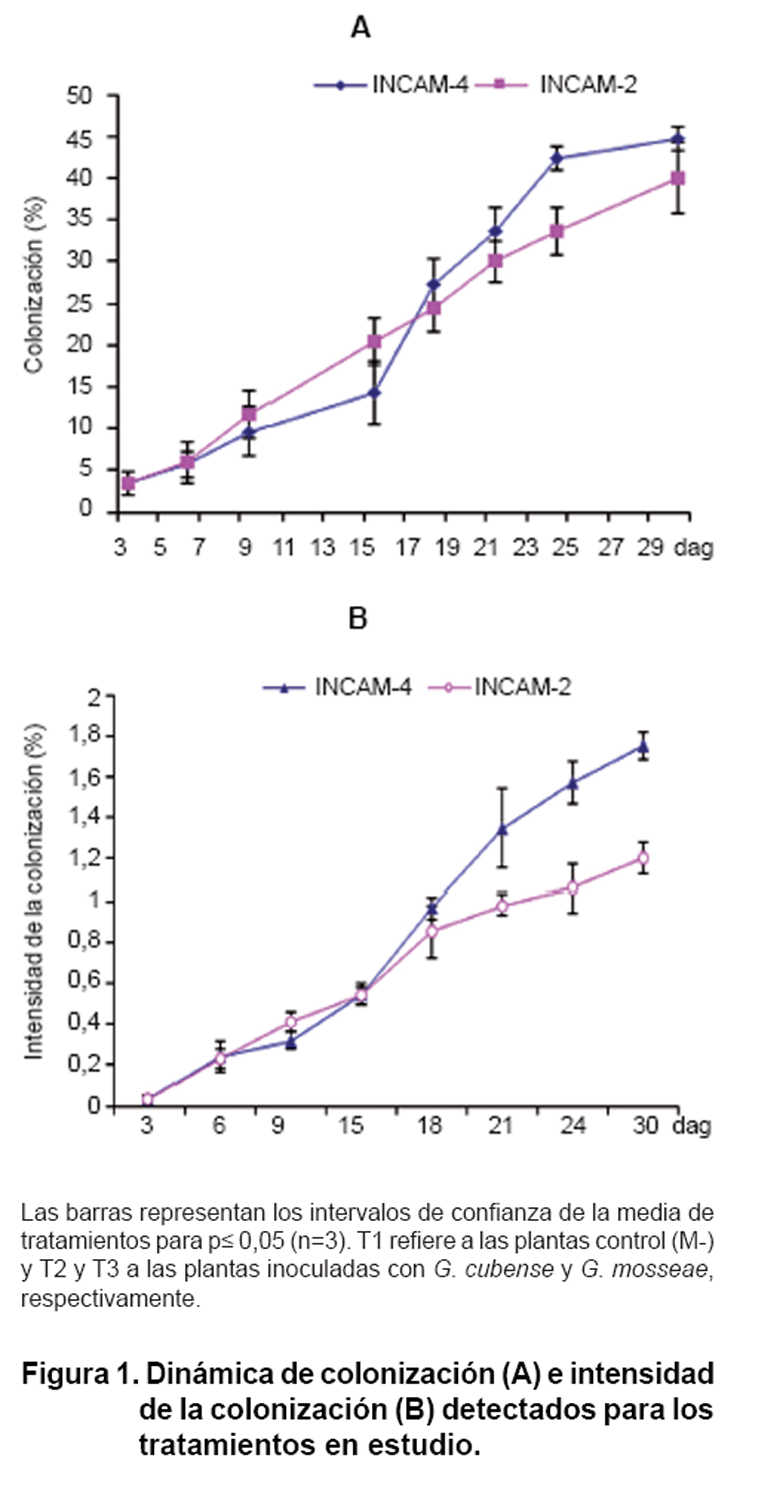
La dinámica de colonización de las cepas de HMA se presenta en la Figura
1A, donde se evidencia un incremento de los niveles de colonización fúngica
que difirió entre ambas cepas de forma significativa en el día 21. Aún cuando
se aprecia una tendencia a ser más altos los niveles de colonización entre los
días 15 y 24 para la cepa G. cubense, no se observaron diferencias estadísticamente
significativas en la capacidad de las cepas para colonizar las plantas de tomate
de la variedad en estudio.
La dinámica de ocupación fúngica se presenta en la Figura
1B. Para ambas cepas los porcentajes de densidad visual se encuentran dentro
de los niveles informados para este cultivo (1,3–1,8 %) (12). Sin embargo, la
cepa G. cubense presentó a partir del día 18, niveles superiores de D.V., que
se corresponden con una mayor cantidad de estructuras de intercambio entre las
plantas de tomate de la variedad Amalia y esta cepa de HMA, comportamiento que
podría estar relacionado con las condiciones de sustrato empleado al ser la
cepa recomendada para estas condiciones de fertilidad (13).
A través de marcadores genéticos específicos, evaluaron la intensidad de la
colonización y la presencia de arbúsculos, en Medicago truncatula (Gaertn) micorrizada
con G. intraradices (Biermann & Lindermar) (14). Estos investigadores encontraron
que al inicio de la interacción HMA-planta el incremento de los arbúsculos era
lento, seguido por una etapa en la cual los niveles de colonización y el contenido
de arbúsculos incrementaba entre los 21 y los 49 días con presencia de todos
los estadíos de desarrollo y senescencia de estos últimos.
En el presente trabajo los niveles de colonización resultaron adecuados dada
la edad del cultivo en condiciones similares (14), lo que indica que la presencia
de arbúsculos, como estructuras de intercambio en el interior de la raíz, se
mantuvo en niveles altos de representación y que la intensidad de la colonización
fúngica medida como D.V. fue elevada para ambas especies de HMA.
Este resultado permitió comprobar que en todos los momentos las dos especies
de HMA se encuentran representadas en altos valores en la micorrizósfera, dados
los niveles de densidad visual observados para la edad del cultivo, lo que se
corresponde con lo señalado por otros autores (13).
El diálogo molecular
que se establece entre la planta y el HMA determina los niveles de colonización
que estos alcanzan y la eficiencia micorrízica observada como intensidad de
la colonización (13), para el caso del cultivo del tomate los porcentajes de
colonización y de ocupación fúngica medidos como densidad visual son entre 40
y 45 % y 4-4,3 % respectivamente para plantas que han completado su ciclo de
vida (14). En el caso de las plantas utilizadas en el experimento se realizó
la dinámica de colonización para demostrar que ambas cepas se encontraban representadas
en niveles adecuados para la edad del cultivo y se empleó un sustrato esterilizado
para disminuir o evitar colonización por HMA nativos de suelo por lo cual las
plantas testigo no desarrollaron colonización.
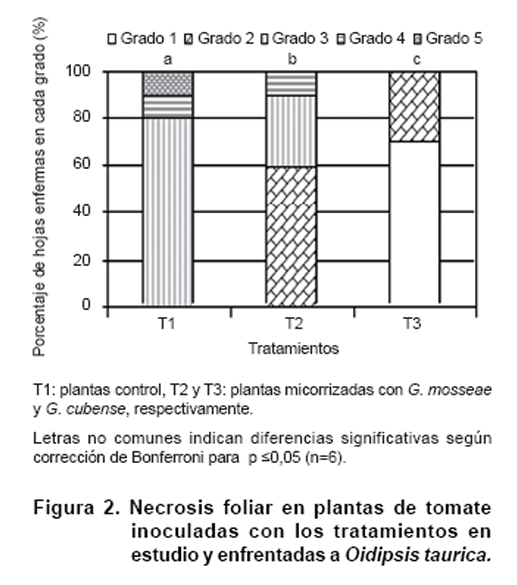
Los porcentajes de necrosis foliar observados en las plantas de tomate bajo
diferentes tratamientos se presentan en la Figura
2. Se observa que en las plantas inoculadas con G. cubense y G. mosseae
los porcentajes de necrosis en relación con el control fueron inferiores. Las
plantas inoculadas con G. cubense se destacaron por disminuir la intensidad
de los daños producidos por el patógeno en dos grados de afectación.
La activación de
PRX para la interacción planta-HMA-O. taurica se representa en la Figura
3. La actividad de la enzima en la raíz confirma el hecho de que esta se
induce de manera local por los HMA (15) y resultó superior para las plantas
micorrizadas respecto a las plantas control.
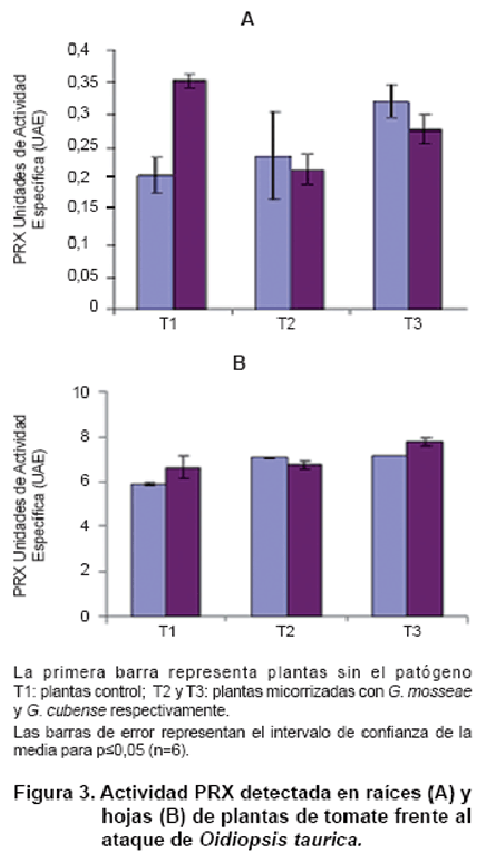
Cuando las plantas se enfrentaron a O. taurica, se observó, en raíz, la disminución
de la actividad de la enzima en las plantas inoculadas con HMA respecto a aquellas
sin inocular y enfrentadas al patógeno y no se apreciaron cambios sustanciales
en el nivel de actividad de esta enzima en hojas, entre las plantas control
y las micorrizadas con G. mosseae. Se observaron diferencias entre estas plantas
y las micorrizadas con G. cubense.
Se ha sugerido que el estallido oxidativo que se produce debido a la citotoxicidad
de especies activas de oxígeno, tales como el anión superóxido y el peróxido
de hidrógeno, así como la rapidez de su producción, constituyen la primera línea
de defensa contra la invasión del patógeno. Esto provoca la muerte directa del
patógeno o retiene su entrada, debido al endurecimiento de la pared celular
por reacción cruzada oxidativa con las proteínas estructurales de la pared.
La toxicidad de las especies activas de oxígeno también puede contribuir a la
muerte celular del hospedante (16). Aunque las diferencias entre especies de
HMA, respecto a la activación enzimática fueron evidentes, se encontró que incluso
los niveles más bajos resultaron satisfactorios para detener el avance del patógeno,
expresado en la disminución de la severidad encontrada para ambas especies de
HMA. No obstante, resultó muy evidente que la especie G. cubense se comportó
de manera más eficiente, disminuyendo la severidad en dos niveles respecto a
las plantas control.
Se ha señalado que hay cierta compatibilidad entre G. cubense y el tomate (12)
por lo que la activación de este mecanismo a los niveles que se aprecian en
este trabajo sugiere que se trató de inducir un mecanismo de muerte celular
programada en un porcentaje mayor para tratar de circunscribir al patógeno al
área de inoculación. El aumento de este proceso, vinculado con el metabolismo
oxidativo, en el tratamiento, donde las plantas fueron retadas con el patógeno,
respecto a los demás, evidenció, una vez más, que el establecimiento de la simbiosis
no sólo beneficia a la planta en cuanto a los parámetros agronómicos, sino también
en cuanto a la protección frente a patógenos.
La Figura 4 presenta
la inducción de PR2 en raíces y hojas de plantas inoculadas con HMA ante el
ataque del patógeno.
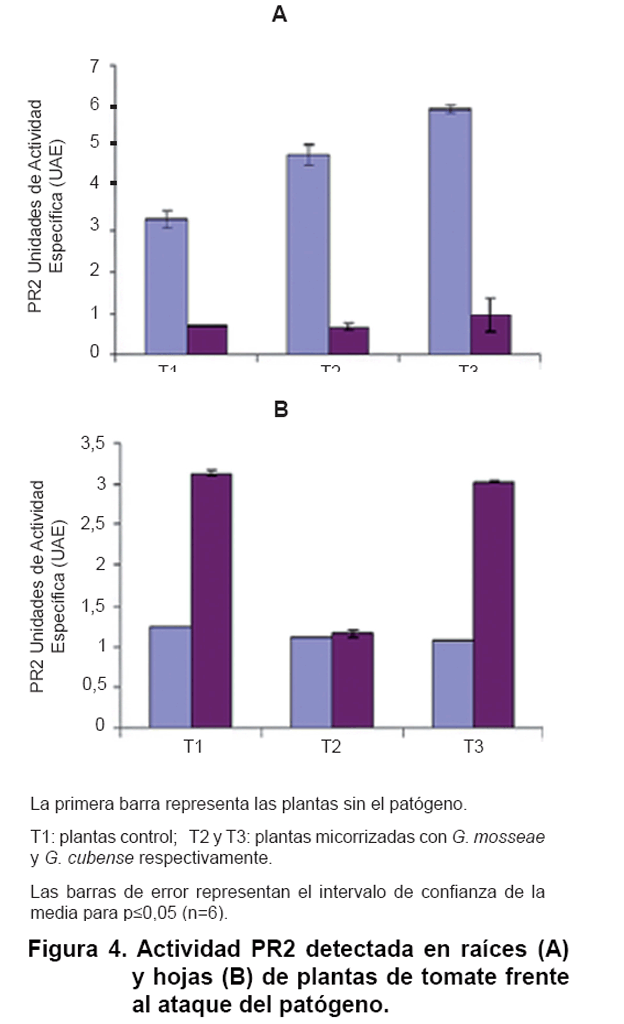
Se observa que
la inducción local de ß 1,3 glucanasa en las raíces de plantas micorrizadas
fue superior en relación con el testigo (Figura
4A), mientras que no se observó inducción de respuesta sistémica en las
plantas inoculadas con HMA, ya que los niveles de actividad PR2 en estas no
se modificaron apreciablemente respecto a las plantas testigo (Figura
4B).
Al enfrentarse al patógeno, en raíz no se observaron diferencias entre los tratamientos
y en el sistema foliar se observó una marcada disminución de la actividad en
las plantas inoculadas con G. mosseae y sin diferencias entre los tratamientos
1 y 3.
La Figura 5 muestra
la inducción de quitinasa en hojas y raíces de las plantas inoculadas con HMA
frente al ataque del patógeno. La actividad en raíces mostró una respuesta local
más elevada en las plantas micorrizadas, que resultó superior para la interacción
con G. mosseae (Figura 5A).
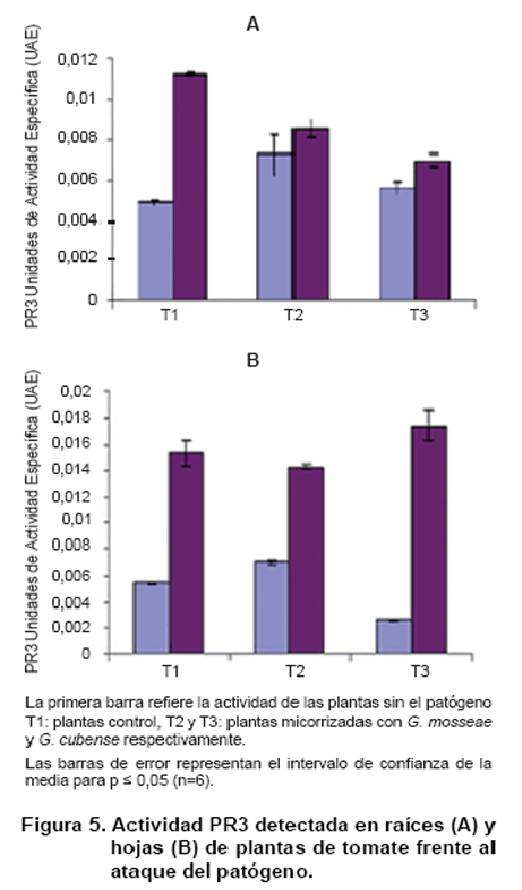
En el enfrentamiento
a O. taurica, se apreció una disminución significativa de la actividad para
las dos cepas de HMA, respecto a las plantas control.
La Figura 5 B muestra
la inducción de actividad PR3 en el sistema foliar, donde se observa una respuesta
diferencial entre las cepas de micorrizas en cuanto a la inducción sistémica
de actividad quitinasa, que fue superior en las micorrizadas con G. mosseae,
respecto a las plantas control e inferior en las micorrizadas con G. cubense.
De forma general, no se presentaron diferencias significativas entre las plantas
control y las micorrizadas frente al ataque del patógeno en los niveles de inducción
de la enzima, aún cuando se encontró una tendencia a la disminución de la actividad
en las plantas micorrizadas con G. mosseae y la actividad de quitinasa fue alta
en todos los tratamientos, por la presencia del patógeno.
Entre las PR proteínas más estudiadas se encuentran las quitinasas y glucanasas
que participan en las respuestas de defensa activa de las plantas frente a patógenos
fúngicos. Estas enzimas catalizan la hidrólisis de polisacáridos que representan
los principales componentes de las paredes celulares de muchos hongos. Además,
la quitina, sustrato de la quitinasa, no está presente en las plantas superiores.
Las quitinasas solas o en combinación con glucanasas pueden degradar las paredes
celulares aisladas de algunos hongos y se ha observado que restringen eficientemente
el crecimiento de estos in vitro (12).
Se ha demostrado por diferentes autores que la micorrización induce respuestas
defensivas en plantas que son subsecuentemente reprimidas en la medida que los
HMA son reconocidos y que esta compatibilidad entre la planta y el simbionte
esta mediada por los genes sym (17) y dado que la eficiencia micorrízica depende
fundamentalmente de la fertilidad del suelo y la cepa de HMA (13, 18), se observa
en el presente estudio que ambas cepas de HMA no inducen respuestas sistémicas
pues no difirieron de forma significativa en los valores de actividad enzimática
de las enzimas en hojas con las plantas sin micorrizar (T1).
Este resultado está en concordancia con lo informado por diversos autores (1,
3, 18), quienes aseguran que no se han detectado PR proteínas en hojas de plantas
micorrizadas. Esto se debe a que estas enzimas actúan no solo en la respuesta
defensiva como ocurre en las interacciones patogénicas sino que permiten el
crecimiento intraradical de estos HMA, por lo que disminuyen el tamaño de los
fragmentos generados por estas enzimas y no constituyen elicitores de respuesta
sistémica (3). Sin embargo, estas situaciones se modifican en el caso en que
las plantas se someten a estrés biótico, presentando diferencias en las inducciones
de la enzima que en algunos casos se diferencian de las plantas controles y
permitió la disminución de la severidad encontrada.
La Figura 6 muestra
la inducción de fenil alanina amonio liasa (PAL) en raíces y hojas de las plantas.
La inducción local de actividad PAL no evidenció diferencias entre las plantas
micorrizadas y estas fueron superiores al testigo. En el enfrentamiento a O.
taurica se apreció una disminución de la actividad para las plantas inoculadas
con HMA respecto a las plantas testigo. Además, se evidenció que en el caso
en que las plantas fueron enfrentadas al patógeno, la actividad resultó más
baja que las plantas en iguales condiciones y sin el patógeno. Este fenómeno
puede deberse a que el enfrentamiento se realizó en tejido foliar y a que el
metabolismo de inducción enzimática representa un gasto energético para la planta
(19).
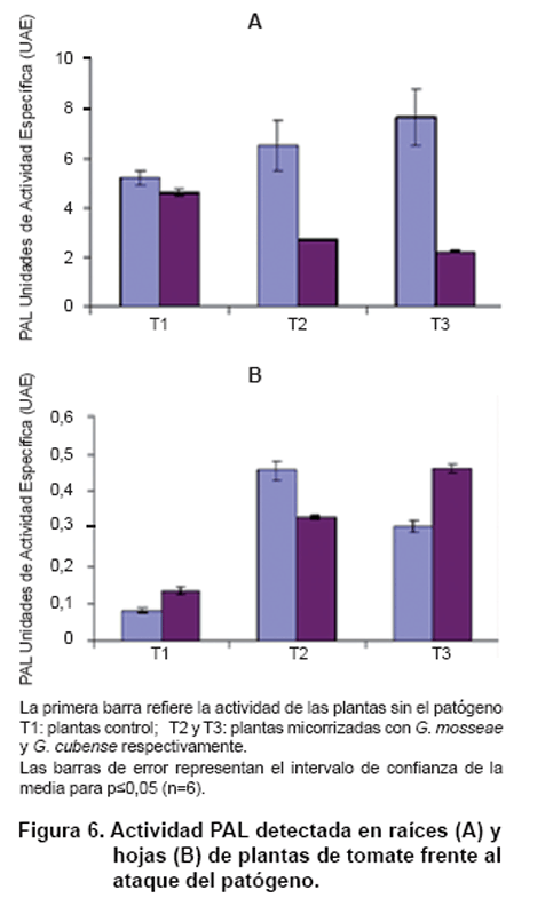
Debe ser menos
costoso para la planta inducir este sistema en la zona donde está actuando el
patógeno, de ahí que por economía celular esta inducción resultó más baja en
la zona de la raíz, aunque se observa actividad, que en este caso puede permitir
a la planta contar con niveles centinelas de la enzima.
La Figura 6B muestra
la inducción de la actividad en el sistema foliar. Se encontró inducción de
respuesta sistémica en las plantas micorrizadas que resultó ser significativa
en aquellas inoculadas con G. mosseae. Cuando las plantas fueron inoculadas
con O. taurica la activación fue evidente para las dos cepas, siendo superior
en las plantas micorrizadas con G. cubense.
La fenilalanina amonio liasa se encuentra involucrada en la vía de los fenilpropanoides
que interviene en la deposición de compuestos fenólicos en las paredes celulares
y su posterior reforzamiento (20), por lo que, aumentos de su actividad como
los que se aprecian en las plantas de los tratamientos del panel B, permiten
suponer que esta se está reforzando contra el avance del patógeno y, por tanto,
se debe esperar una disminución del daño.
La Figura 7 muestra
el resultado del análisis de componentes principales para las combinaciones
de las actividades PRX, PR2, PR3 y PAL con el efecto producido por el patógeno
en plantas de tomate de la var. Amalia. Se encontró que las dos primeras componentes
explican el 82,32 % de la variabilidad de los datos. Al componente uno aportan
las variables severidad producida por los patógenos, ß 1,3 glucanasa en hojas
y raíz, PRX en raíz y quitinasa en raíces y hojas, y al componente dos PRX y
PAL en hojas.
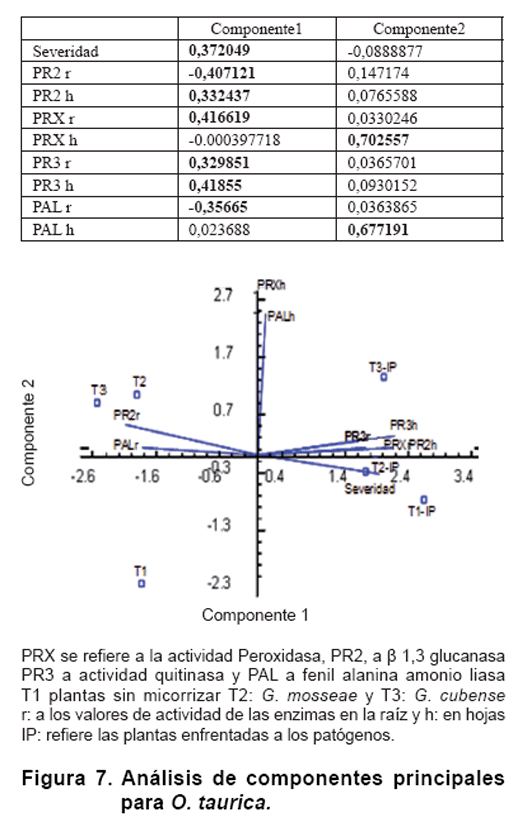
Como se observa, no se encontró relación entre el daño producido por el patógeno
y la actividad PRX y PAL en hojas. Esta relación resultó positiva con quitinasa
en raíces y hojas, con PRX en raíces y con ß 1,3 glucanasa en hojas, resultando
negativa con ß 1,3 glucanasa y PAL en raíces.
Cuando se compararon las plantas enfrentadas al patógeno con las plantas sin
inoculación de patógeno, se observó que la presencia del mismo disminuye la
expresión de glucanasa y PAL en raíces e incrementa las actividades de quitinasas
en raíces y hojas, de PRX en raíces y de ß 1,3 glucanasa en hojas (Figura
7).
Los HMA son inductores de mecanismos de defensa y, por tanto, pueden influenciar
en los estrés bióticos de las plantas. Sin embargo, la premisa fundamental para
lograr resistencia inducida por los HMA es que la asociación micorrízica esté
bien establecida (21), premisa que se cumple en este estudio.
Está ampliamente documentado en la literatura el efecto benéfico de estos HMA
en la bioprotección contra patógenos de raíz, entre los que se encuentran especies
de Aphanomyces, Cylindrocladium, Fusarium, Macrophomina, Pythium, Rhizoctonia,
Sclerotium, Verticillium y Thielaviopsis (1, 17). Se ha informado que la micorrización
protege a las plantas de tomate frente al ataque de la bacteria Erwinia carotovora
Smith., además de producir la disminución en la población del microorganismo
en la rizosfera. Otro de los grupos de patógenos en los que se estudió la influencia
de los HMA por los daños que causan a la agricultura, son los nemátodos formadores
de agallas de la especie Meloidogyne incognita (1). Se ha relacionado la reducción
del índice de la enfermedad causada por P. parasítica Dastur (sin: Phytophthora
nicotianae Breda de Hann) y la inducción de proteínas del grupo de las PRs por
Glomus mosseae.
Sin embargo, existen pocos estudios relacionados con la bioprotección de plantas
micorrizadas contra patógenos foliares. En el presente estudio se observó que
la inoculación con ambas cepas de HMA redujo la severidad de la enfermedad producida
por este patógeno, lo cual constituye un informe novedoso de la utilización
de estos en la bioprotección.
En las plantas micorrizadas, los niveles de AJ se incrementan con respecto a
las plantas sin micorrizar (22) y se ha observado que este incremento activa
genes involucrados con la defensa de plantas como las enzimas de la vía de los
fenilpropanoides y la producción de PRs (22). Para el caso de la cenicilla,
se observó que la disminución de los daños estaba relacionada con el aumento
de la inducción de ß 1,3 glucanasa en hojas y quitinasas en hojas y raíz, mecanismos
que se inducen por la vía del jasmonato. Además, se debe observar que aun cuando
las plantas micorrizadas presentaron activaciones de los sistemas defensivos
estos, en algunos casos, presentaron activaciones superiores cuando se enfrentaron
a los patógenos, lo que permite aseverar que existió un condicionamiento de
la respuesta defensiva (3, 23, 24, 25) que permitió la disminución de la severidad
del patógeno.
CONCLUSIONES
De forma general
se pudo observar que:
• Los HMA G. mosseae y G. cubense se establecieron en la micorrizosfera en niveles
adecuados para la edad del cultivo.
• Ambas especies resultaron efectivas en la disminución de la severidad de O.
taurica y resultó más efectiva la especie G. cubense que logró disminuciones
de la severidad de hasta dos niveles respecto a las plantas testigo.
• Se observó inducción diferencial de PRs en raíz y hojas que resultó efectivo
en la disminución de la severidad producida por este patógeno.
• Se observó condicionamiento de estas respuestas en las plantas micorrizadas
que determinaron las reducciones de la severidad ocasionada por el patógeno.
BIBLIOGRAFÍA
1. López-Ráez,
J. A.; Bouwmeester, H. y Pozo, M. J. Communication in the Rhizosphere, a Target
for Pest Management. Agroecology and Strategies for Climate Change. Sustainable
Agriculture Reviews, 2011, vol. 8. DOI 10.1007/978-94-007-1905-7_5.
2. Bever, J. D.; Dickie, I. A.; Facelli, E.; Facelli, J. M.; Klironomos, J.;
Moora, M.; Rillig, M. C.; Stock, W. D.; Tibbett, M. y Zobel, M. Rooting theories
of plant community ecology in microbial interactions. Trends in Ecology and
Evolution, 2010, vol. 25, pp. 468-478. ISSN 0169-5347.
3. Jung, S. C.; Martinez-Medina, A.; Lopez-Raez, J. A. y Pozo, M. J. Mycorrhiza-Induced
Resistance and Priming of Plant Defenses. J. Chem. Ecol., 2012, vol. 38, pp.
651-664. ISSN 1573-1561.
4. Álvarez, M. /et al./. Amalia: A medium-fruit-size, heat-tolerant tomato cultivar
for tropical conditions. Hort. Science, 2004, vol. 39, pp. 1503-1504. ISSN 2327-9834.
5. Rodríguez, Y.; Dalpé, Y.; Séguin, S.; Fernández, K.; Fernández, F. y Rivera,
R. A. Glomus cubense sp. nov., An arbuscular mycorrhizal fungus from Cuba. Mycotaxon,
2011, vol. 118, pp. 337-347. ISSN 0093-4666.
6. Rodríguez, Y.; van Tuinen, D. y Fernández, K. Reclasificación taxonómica
de dos cepas de hongos micorrízicos arbusculares. Cultivos Tropicales, 2009,
vol. 30, no. 1, pp. 31-35. ISSN 1819-4087.
7. Phillips, J. M. y Hayman, D. E. Improved procedures for clearing roots and
staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment
of infection. Trans. Br Mycol. Soc., 1972, vol. 55, pp. 158-161. ISSN 0007-1536.
8. Giovanetti, M. y Mosse, B. An evaluation of techniques to measure vesicular-arbuscular
infection in roots. New Phytologist, 1980, vol. 84, pp. 489-500. ISSN 1469-8137.
9. Trouvelot, A.; Kough, J. y Gianinazzi-Pearson, V. Mesure du taux de mycorhization
VA d'un systeme radiculaire. Recherche de methodes d'estimation ayantune signification
fonctionnelle. In: Proceedings of the 1st European Symposium on Mycorrhizae:
Physiological and Genetical Aspects of Mycorrhizae, Dijon, 1-5 July, 1985. (Gianinazzi-Pearson,
V. y Gianinazzi, S., eds.). Paris: INRA. 1986. pp. 217-222.
10. Schaefer, S. C. /et al./. Enhanced resistance to early blight in transgenic
tomato lines expressing heterologous plant defense genes. Planta, 2005, vol.
222, pp. 858-866. ISSN 1432-2048.
11. Dayton, C. M. y Schafer, N. D. Extended Tables of t and chi sguare for Bonferroni
Test with unequal Error Allocation. JASA Asoc., 1973, vol. 68, pp. 78-83.
ISBN 1537-274X.
12. de la Noval, B. M. ; Pérez, E.; Martínez, B.; León, O.; Martínez-Gallard,
N. y Délano-Frier, J. Exogenous systemin has a contrasting effect on disease
resistance in mycorrhizal tomato (Solanum lycopersicum) plants infected with
necrotrophic or hemibiotrophic pathogens. Mycorrhiza, 2007, vol. 17, no. 5,
pp. 449-460. ISSN 1432-1890.
13. Rivera, R.; Fernádez, F.; Fernández, K.; Ruiz, L.; Sánchez, C. y Riera,
M. Chapter 5. Advances in the Management of Effective Arbuscular Symbiosis in
Tropical Ecosystems. En: Ed. Hamel. C. y Plenchette, C. Mycorrhizae in Crop
Productions. 2007. pp. 151-195. ISBN 9781560223061.
14. Schliemann, W.; Ammer, C. y Strack, D. Metobolite profiling of mycorrhizal
roots of Medicago truncatula. Phytochem, 2008, no. 69, pp. 112-146. ISSN 0031-9422.
15. Bressano, M.; Curetti, M.; Giachero, L.; Vargas Gil, S.; Cabello, M.; March,
G.; Ducasse, D. A. y Luna, C. M. Mycorrhizal fungi symbiosis as a strategy against
oxidative stress in soybean plants. Journal of Plant Physiology, 2010, vol.
167, no. 18, pp. 1622-16256. ISSN 0176-1617.
16. Bao, G.; Bi, Y.; Li, Y.; Kou, Z.; Hu, L.; Ge, Y.; Wang, Y. y Wang, D. Overproduction
of reactive oxygen species involved in the pathogenicity of Fusarium in potato
tubers. Physiological and Molecular Plant Pathology, 2014, vol. 86, pp. 35-42.
ISSN 0885-5765. <http://dx.doi.org/10.1016/j.pmpp.2014.01.004>.
17. Zamioudis, C. y Pieterse, C. M. J. Modulation of Host Immunity by Beneficial
Microbes. MPMI, 2012, vol. 2, no. 25, pp. 139-150. ISSN 0894-0282.
18. Smith, S. E. y Smith, F. A. Roles of Arbuscular Mycorrhizas in Plant Nutrition
and Growth: New Paradigms from Cellular to Ecosystem Scales. Annual review of
plant biology, 2011, vol. 62, pp. 227-250. ISSN 1543-5008.
19. Walters, D. y Heil, M. Costs an trade-offs associated with induce resistance.
Physiol. Mol. Plant Pathol, 2007, vol. 71, pp. 3-7. ISSN 0885-5765.
20. van Loon, L. C.; Rep, M. y Pieterse, C. M. J. Significance of inducible
defense. related proteins in infected plants. Annu. Rev. Phytopathol, 2006,
vol. 44, pp. 135-162. ISSN 0066-4286.
21. Kiers, T.; Duhamel, M.; Beesetty, Y.; Mensah, J. A. /et al./ Reciprocal
Rewards Stabilize Cooperation in the Mycorrhizal Symbiosis. Science, 2011, vol.
333, no. 6044, pp. 880-882. ISSN 1095-9203.
22. Arafat, A. H. A. L. y He, C. Effect of arbuscular mycorrhizal fungi on growth,
mineral nutrition, antioxidant enzymes activity and fruit yield of tomato grown
under salinity stress. Sc. Hort., 2011, vol. 27, no. 3, pp. 228-233. ISSN 0304-4238.
23. Verbruggen, E.; van der Heijden, M. G. A, Rillig, M. C. y Kiers, E. T. Mycorrhizal
fungal establishment in agricultural soils: factors determining inoculation
success. New Phytologist, 2012, vol. 197, no. 4, pp. 1104-1109. ISSN 1469-8137.
doi: 10.1111/j.1469-8137.2012.04348.
24. Tisserant, E.; Kohler, A.; Dozolme-Seddas, P.; Balestrini, R.; Benabdellah,
K. /et. al./. The transcriptome of the arbuscular mycorrhizal fungus Glomus
intraradices (DAOM 197198) reveals functional tradeoffs in an obligate symbiont.
New Phytologist, 2011, vol. 193, no. 3, pp. 755-769. ISSN 1469-8137. doi: 10.1111/j.1469-8137.2011.03948.
25. Kloppholz, S.; Kuhn, H. y Requena, N. A Secreted Fungal Effector of Glomus
intraradices Promotes Symbiotic Biotrophy. Current Biology, 2011, vol. 21, no.
14, pp. 1204-1209. ISSN 0960-9822.
Recibido: 8 de
octubre de 2013
Aceptado: 2 de abril de 2014
Dr.C.
Eduardo Pérez Ortega, Instituto
Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas,
Mayabeque, Cuba. CP 32 700. Email: eduardo@inca.edu.cu








