
Utilización de haplotipos de Pyricularia grisea Sacc. Aislados en Cuba para la selección de cultivares de arroz resistentes a la Piriculariosis
Use Pyricularia grisea Sacc. haplotypes isolated on Cuba for selection of rice cultivars resistant to the Piriculariosis
Dra.C. Noraida de J. Pérez León,I Dra.C. María C. González Cepero,I Ramona Márquez,I Dr.C. Rodolfo I. Castro Menduiña,I Dr.C. Manuel Aguilar PorteroII
IInstituto
Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas,
Mayabeque, Cuba, CP 32 700.
IIDepartamento de Arroz y Maíz del Centro de Investigación y Formación
Agraria (CIFA) Las Torres Tomejil, Alcalá del Río, Sevilla, España.
RESUMEN
El principal problema fitopatológico que provoca los bajos rendimientos del cultivo del arroz en Cuba es la Piriculariosi, por tal motivo se evaluaron, en condiciones controladas y con inoculación artificial, tres haplotipos de P. grisea aislados en Cuba de plantas de arroz en dos zonas de producción. Estos fueron posteriormente utilizados en la selección de cultivares de arroz resistentes a la enfermedad. Los resultados permitieron la selección de los haplotipos A 18 y B 6 para la evaluación de cultivares en condiciones semicontroladas y, de esta forma, quedan representados dos linajes del patógeno y, entre ellos, el más agresivo y ampliamente distribuido. Se seleccionaron siete líneas resistentes frente a los haplotipos evaluados, las que constituyen una importante base germoplásmica para la obtención de cultivares resistentes.
Palabras clave: Oryza sativa, cultivo de anteras, virulencia.
ABSTRACT
Piriculariosis (Blast disease) is the main phytopathologic problem that causes low rice yields in Cuba. For this reason, three P. grisea haplotypes isolated in Cuba from rice plants in two production areas, were evaluated in controlled conditions and with artificial inoculation. Later they were used in breeding rice varieties to blast resistant. The obtained results suggest the selection of haplotypes A 18 and B 6 for rice varieties evaluation under control conditions and, in this way, two lineages of blast are represented, as well as the broadly distributed and aggressive lineage. Seven resistant lines to the evaluated haplotypes were selected. They constitute an important germoplasm basement to obtain resistant rice varieties.
Key words: Oryza sativa, anther culture, virulence.
INTRODUCCIÓN
Entre las plagas
importantes que atacan al cultivo del arroz se destaca el hongo Magnaporthe
grisea Barr (Pyricularia grisea Sacc) que provoca la Piriculariosis, enfermedad
considerada como la más devastadora a nivel mundial, debido a su amplia distribución
(1). Afecta hojas, tallos, nudos de la planta y las diferentes partes de las
panículas y granos, lo que produce una significativa disminución en los rendimientos
agrícolas y, en ocasiones, la pérdida completa de la cosecha, todo lo cual presenta
a esta enfermedad como una seria limitación en la producción de este cultivo,
que de este modo, se convierte en el principal problema fitopatológico de Cuba.
La Piriculariosis es considerada como una patología compleja, debido a su variabilidad
patogénica (2). En Cuba fue determinada la diversidad genética del hongo y las
características estructurales de las poblaciones (linajes y haplotipos), lo
que puede contribuir de manera significativa al establecimiento de estrategias
de mejoramiento basadas en la teoría de exclusión de linajes, tomando en cuenta
que en cada región donde se cultiva arroz existen grupos de linajes diferentes
y, por lo tanto, es importante la selección de progenitores que aporten genes
de resistencia a dichos grupos (3).
Por otra parte, en todo programa de mejora para resistencia a enfermedades,
se necesita poseer la fuente de resistencia genética, establecer las condiciones
idóneas de infección del patógeno, con el fin de garantizar una efectiva selección
y escoger el método de mejoramiento adecuado.
Dentro de ellos, el cultivo in vitro de anteras de plantas F2 presenta numerosas
ventajas, ya que la población proveniente de esta combinación de métodos de
mejora (hibridaciones y cultivo in vitro), representa la variabilidad genética
de la población F2 y las plantas obtenidas in vitro son genéticamente homocigóticas.
Esto reduce el tiempo para la obtención de los nuevos cultivares, ahorra recursos
financieros y materiales y aumenta la eficiencia de la selección, lo cual facilita
la identificación de individuos superiores (4, 5, 6, 7)A.
Teniendo en cuenta la problemática planteada fue concebido este trabajo que
tuvo como objetivo evaluar la patogenicidad de tres haplotipos del hongo P.
grisea identificados en Cuba para su utilización posterior en la selección de
cultivares resistentes a la enfermedad.
MATERIALES Y MÉTODOS
Evaluación de
haplotipos de P. grisea aislados en Cuba para su utilización en la selección
de cultivares resistentes a la enfermedad
Se reactivaron tres haplotipos de P. grisea, que se encontraban conservados
en la micoteca del Centro de Aplicaciones Tecnológicas y Desarrollo Nuclear
(CEADEN) desde el año 1998, los que fueron aislados de plantas de arroz en dos
zonas de producción (Tabla I) y pertenecen a los dos linajes
de mayor variabilidadB.

Pequeñas porciones de micelios de los haplotipos fueron sembradas en placas Petri que contenían Agar Agua (Tabla II); después de 72 horas se realizaron cultivos monospóricos en medio SA (salvado de arroz), los que se incubaron durante siete días a 28± 2 0C y oscuridad. A partir de los cultivos puros, de los haplotipos en estudio, se tomaron discos de micelio de 5 mm de diámetro que fueron sembrados separadamente en el medio de cultivo PDA, con pH 5,6 y elaborado con extracto de papa natural de la variedad ‘Desiré’, cosechada en el área central del Instituto Nacional de Ciencias Agrícolas (INCA).

Para
la evaluación de los haplotipos, se desinfectaron semillas del cultivar ‘J-104’,
con hipoclorito de sodio al 1,5 % durante un minuto que luego se enjuagaron
varias veces con agua destilada. Posteriormente, estas se sembraron en macetas
que contenían una mezcla de suelo Gley Nodular Ferruginoso petroférrico (8)
y cachaza curada, en proporción 3:1. El suelo fue previamente esterilizado durante
una hora en autoclave a 121 0C por tres días consecutivos.
La densidad de siembra fue de 20 semillas por maceta y se utilizaron cinco macetas
(repeticiones) por cada haplotipo a evaluar. A los 21 días de germinadas las
plantas se realizaron las inoculaciones artificiales, con un atomizador manual
que contenía suspensiones de esporas del patógeno ajustadas a una concentración
de 106 conidios por mililitro y una dosis de 2 mL por maceta (9). Seguidamente
se propiciaron condiciones de alta humedad y temperatura favorables para el
desarrollo de la enfermedad.
En 10 plantas por aislamiento se evaluó el período de incubación, el tamaño
de las lesiones (en milímetros) y el área foliar afectada. Fue considerado como
haplotipo más agresivo el que afectó mayor porcentaje de área foliar y las lesiones
fueron mayores. Los datos de área foliar afectada fueron transformados a arcsen
v % y tanto esta como el tamaño de las lesiones se procesaron mediante Análisis
de Varianza de Clasificación Simple. Las medias se contrastaron según la Prueba
de Tukey al 5 % de probabilidad de error. Se seleccionaron los haplotipos de
P. grisea que fueron utilizados en la selección de cultivares resistentes a
la enfermedad.
Selección de líneas isogénicas resistentes a la Piriculariosis en condiciones
semicontroladas con inoculación artificial
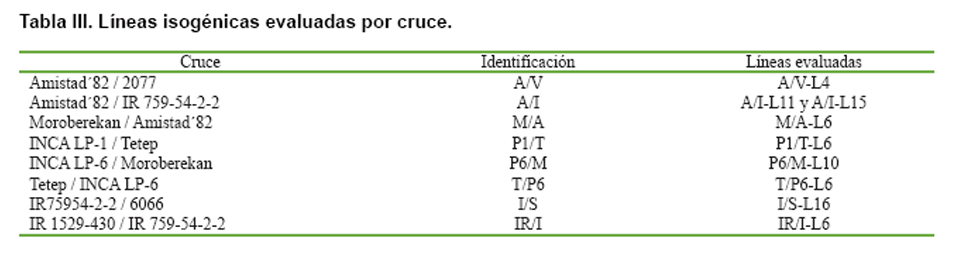
Para la realización del ensayo, se utilizaron 1,5 g de semillas sanas de líneas
isogénicas (Tabla III),
seleccionadas por su resistencia
frente a la Piriculariosis con infección natural en campo (10), las cuales provenían
del cultivo in vitro de anteras de plantas F2 de cruzamientos realizados entre
cuatro cultivares resistentes a la Piriculariosis (2077, IR 759-54-2-2, Moroberekan
y Tetep) y cinco cultivares de buen comportamiento agronómico (Amistad´82, INCA
LP-1, INCA LP-6, 6066 e IR1529-430). Las que fueron sembradas en bandejas metálicas,
replicadas dos veces, sobre papel de filtro estéril, distribuidas en surcos
de 0,5 metros (200 kg ha-1).
A los 21 días de germinadas las plantas fueron inoculadas de forma independiente
con los haplotipos 18, del Linaje A y 6, del Linaje B, del patógeno, siguiendo
un procedimiento similar y concentración de conidios a los desarrollados para
la evaluación de los haplotipos. La dosis empleada fue de 5 mL por surco (9).
Se utilizaron, además, como patrones resistentes los cultivares ‘2077’, ‘IR
759-54-2-2’, ‘Moroberekan’ y ‘Tetep’ y, como susceptible, el cultivar ‘J-104’.
En 10 plantas por línea y haplotipo se evaluó el período de incubación del hongo
(días), el tamaño de las lesiones (mm) y el porcentaje de área foliar afectada,
en la fase vegetativa. Los datos de área foliar fueron transformados a arcsen
v % y tanto esta como el tamaño de las lesiones se procesaron mediante Análisis
de Varianza de Clasificación Simple. Las medias se contrastaron según la Prueba
de Tukey al 5 % de probabilidad de error.
Se realizó la selección de líneas isogénicas teniendo en cuenta la resistencia
mostrada (grados entre 0 y 3) de acuerdo con la escala propuesta por el IRRI
(11), frente a los haplotipos de P. grisea empleados.
RESULTADOS Y DISCUSIÓN
Evaluación de
haplotipos de P. grisea aislados en Cuba para su utilización en la selección
de cultivares resistentes a la enfermedad
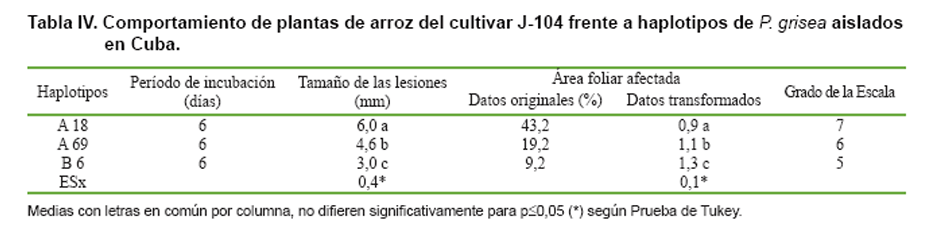
Al evaluar el comportamiento del cultivar J-104 frente a haplotipos de P. grisea
aislados en Cuba (Tabla
IV), se observaron los primeros síntomas seis días después del contacto
inicial del patógeno con la superficie de las hojas, para todos los haplotipos.
Las primeras manchas fueron pardas, similares a pequeños puntos café y, entre
los 9 y 14 días, las mismas presentaron forma de diamante con el centro blanquecino
y bordes amarillentos. La descripción de los síntomas referidos en este trabajo
coincidió con las de otros autores, que trabajaron con este mismo cultivar (J-104),
los cuales informaron un período de incubación de siete días y máximo desarrollo
de las lesiones a los 14 días (12).
Al analizar el valor promedio del tamaño de las lesiones y el porcentaje de
área foliar afectada, se observó que el cultivar ‘J-104’ fue susceptible frente
a todos los haplotipos probados, según la escala propuesta por el IRRI (11).
El haplotipo A18 resultó ser el más agresivo, pues ocasionó mayor porcentaje
de área foliar afectada, manchas en forma de huso o diamante y de mayor tamaño.
Asimismo, el haplotipo perteneciente al linaje B exhibió menor agresividad que
los dos haplotipos agrupados en el linajeA.
En estudios realizados con la población del patógeno presente en los CAI Arroceros
“Los Palacios” y “Sur del Jíbaro”, los haplotipos fueron clasificados en cuatro
linajes genéticos y destacó el linaje A, como el más ampliamente distribuidoB.
Se corrobora la susceptibilidad del cultivar ‘J-104’ frente P. grisea antes
mencionada en trabajos desarrollados en Cuba, tanto en producción, como en condiciones
controladas (12, 13).
En resumen, fue seleccionado el haplotipo A18 para la evaluación de cultivares
en condiciones semicontroladas con inoculación artificial, y se tomará en cuenta
de todas formas al haplotipo B 6 por pertenecer a otro linaje del patógeno.
La utilización de estos haplotipos para la evaluación de cultivares de arroz,
sería útil en la selección de genes de resistencia para las poblaciones patogénicas
de P. grisea presentes en Cuba. A partir de allí se pudieran piramidar genes
que confieran resistencia a diferentes linajes y, de esta forma, lograr mayor
durabilidad de la misma frente a ataques del mencionado patógeno.
Selección de líneas isogénicas resistentes a la Piriculariosis en condiciones
semicontroladas con inoculación artificial
Líneas seleccionadas por su resistencia frente a la Piriculariosis con infección
natural en campo y buen comportamiento agronómico (10), (provenientes del cultivo
in vitro de anteras de plantas F2 de cruzamientos realizados entre cultivares
resistentes a la enfermedad y cultivares de buen comportamiento agronómico),
al ser evaluadas frente a los haplotipos A18 y B6 en condiciones semicontroladas,
mostraron los primeros síntomas a los seis días desde la inoculación, al igual
que en el ensayo de patogenicidad (Tabla
V).
Las primeras lesiones observadas fueron pardas, semejantes a pequeños puntos
café y, entre los nueve y 14 días, adquirieron forma de diamante, con el centro
blanquecino y bordes amarillentos alrededor de la lesión. El haplotipo A18,
también en este caso, resultó ser más agresivo con mayor porcentaje de área
foliar afectada y lesiones de mayor tamaño en el cultivar susceptible J-104.
Las líneas ‘A/I-L15’ e ‘IR/I-L6’, que en la evaluación efectuada anteriormente
(10) habían mostrado resistencia, se manifestaron susceptibles en este ensayo,
con tamaño de las manchas superior a 3 mm y porcentajes de área foliar afectada
mayores al 10 %, sin diferencias estadísticas significativas con el control
susceptible ‘J-104’, lo que las ubicó entre los grados cinco y siete de la escala.
El resto de las líneas se mostró resistente, con valores similares a los patrones.
Fuentes (1998)B encontró que en condiciones naturales, sólo un cultivar cubano
de los estudiados mostró resistencia intermedia al patógeno y, a partir de ‘J-104’
fue aislado el mayor número de haplotipos de la población del hongo, de ahí
la importancia de obtener nuevas líneas que presenten resistencia al ataque
del mismo.
La presencia de la enfermedad en las diferentes fenofases del cultivo está muy
relacionada con la ocurrencia de condiciones ambientales óptimas, pero su desarrollo
depende de las características genéticas de los cultivares y de la variabilidad
del patógenoC, de ahí la necesidad de evaluar las líneas obtenidas en la época
que mayores afectaciones provoca la enfermedad y en la localidad seleccionada
como “hot spot”: la Unidad Empresarial Base Agrícola “Caribe”, perteneciente
al Complejo Agroindustrial Arrocero “Los Palacios”, la que según los resultados
de diversos autores, se ratifica como ideal para la evaluación de la enfermedad
en Cuba (14, 15, 16)C.
Las líneas ‘A/V-L4’, ‘A/I-L11’, ‘M/A-L6’, ‘P1/T-L6’, ‘P6/M-L10’, ‘T/P6-L6’ y
‘I/S-L16’, que fueron seleccionadas como resistentes frente a los haplotipos
evaluados, constituyen una importante base para la obtención de cultivares resistentes.
Se hace necesario, también, comprobar su resistencia en condiciones de infección
natural, ya que esto garantiza el desarrollo de cultivares con resistencia duradera
a la enfermedad causada por el hongo P. grisea.
BIBLIOGRAFÍA
1. Silva, G.;
Prabhu, A.; Filippi, M.; Trindade, M.; Araújo, L. y Zambolim, L. Genetic and
phenotypic diversity of Magnaporthe oryzae from leaves and panicles of rice
in commercial fields in the State of Goiás, Brazil. Tropical Plant Pathology,
2009, vol. 34, no. 2, pp. 77-86. ISSN 1982-5676.
2. Anjos, L. M.; Santos, G. R., Dias-Neto, J. J., /et al./. Identification of
physiological races of Magnaporthe grisea in areas of rice irrigated in the
State of Tocantins. Tropical Plant Pathology, 2009, vol. 34, no. 3, pp. 80.
ISSN 1982-5676.
3. Franco, M. A. y Galindo-Castro, I. ¿De qué nos sirven los microarreglos en
la identificación de genes de resistencia? Ejemplo Arroz-Pyricularia grisea.
Fitopatología Venezolana, 2009, vol. 22, no. 2, pp. 86. ISSN 0798-0035.
4. Gueye, T. y Ndir, K. In vitro production of double haploid plants from two
rice species (Oryza sativa L. and Oryza glaberrima Steudt.) for the rapid development
of new breeding material. Scientific Research and Essays, 2010, vol. 5, no.
7, pp. 709-713. ISSN 1992-2248.
5. MINAG-Perú. Arroz. Producción Mundial. [en línea]. Portal Agrario. Cultivos
de importancia nacional. 2010. [Consulta: 10 Enero 2010]. Disponible en: <http://www.minag.gob.
pe/arroz/ produccion.htm1>.
6. Herath, H. M.; Bandara, D. C.; Samarajeewa, P. K. y Wijesundara, D. S. Effect
of low temperature pre-treatment on anther culture in selected indica, japonica
rice varieties and their inter sub-specific hybrids. Cey. Journal Science (Bio.
Sci.), 2009, vol. 38, no. 1, pp. 11-16. ISSN 0069-2379.
7. Silva, T. D. y Ratnayake, W. J. Anther culture potential of indica rice varieties,
kurulu thuda and Bg 250. Tropical Agricultural Research & Extension, 2009,
vol. 12, no. 2, pp. 53-56. ISSN 1391-3646.
8. Hernández, A.; Pérez, J. M.; Bosch, D. y Rivero, L. Nueva Versión de clasificación
genética de los suelos de Cuba. La Habana: AGRINFOR. 1999. 64 pp. ISBN 959-246-022.
9. Guimarães, E. P.; Ospina, R. y Correa-Victoria, F. Empleo del concepto de
linajes de Pyricularia grisea para escoger germoplasma de arroz resistente.
Revista Fitopatología Venezolana, 2010. [Consultado: 15 Junio 2010]. Disponible
en: <http://www.redpav-fpolar.
info.ve/fitopato/ v091/091f0001.htm1>.
10. Pérez, Noraida de J., González, Maria C., Castro, R. I. y Aguilar, M. Nuevos
genotipos de arroz resistentes a la Piriculariosis obtenidos por cultivo de
anteras. Revista Colombiana de Biotecnología, 2012, vol. XIV, no. 1, pp. 243-252.
ISSN 1909-8758.
11. IRRI. Standard Evaluation System for Rice. Filipinas: International Rice
Research Institute (IRRI). 2002. 56 pp.
12. Rodríguez, A. T.; Ramírez, M. A.; Cárdenas, R. M.; Hernández, A.; Velásquez,
M. G. y Bautista, S. Induction of defence response of Oryza sativa L. against
Pyricularia grisea (Cooke) Sacc. by treating seeds with chitosan and hydrolyzed
chitosan. Pesticide Biochemistry and Physiology, 2007, vol. 89, pp. 206-215.
ISSN 0048-3575.
13. Morejón, R., Hernández, J. J. y Díaz, S. Comportamiento de variedades comerciales
de arroz (Oryza sativa) en cuatro Granjas del Complejo Agroindustrial Arrocero
Los Palacios. Cultivos Tropicales, 2005, vol. 26, no. 4, pp. 77-81. ISSN 1819-4087.
14. Cárdenas, R. M.; Mesa, S.; Polón, R.; Pérez, N.; Cristo, E.; Fabré, L. y
Hernández, J. J. Relación entre la incidencia de la piriculariosis (Pyricularia
grisea Sacc.) del arroz (Oryza sativa Lin.) y diferentes variables climáticas
en el Complejo Agroindustrial Arrocero Los Palacios. Cultivos Tropicales, 2010,
vol. 31, no. 1, pp. 14-18. ISSN 1819-4087.
15. Cárdenas, R. M.; Pérez, N.; Cristo, E.; González, M. C. y Fabré, L. Estudio
sobre el comportamiento de líneas y variedades de arroz (Oryza sativa) ante
la infección por el hongo Pyricularia grísea. Cultivos Tropicales, 2005, vol.
26, no. 4, pp. 83-87. ISSN 1819-4087.
16. Cárdenas, R. M.; Pérez, N.; Cristo, E. y González, M. C. Evaluación del
vaneo de los granos en genotipos de arroz (Oryza sativa Lin.) sembrados en camas
de infección. Revista Protección Vegetal, 2005, vol. 20, no. 3, pp. 179-184.
ISSN 2224-4697.
Recibido: 9 de enero de
2014
Aceptado: 12 de diciembre de 2014
Dra.C. Noraida de J. Pérez León, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32 700. Email: nory@inca.edu.cu