Efecto
del tratamiento a las semillas con quitosana en el crecimiento de plántulas
de arroz (Oryza sativa L.) cultivar INCA LP-5 en medio salino
Effect
of seed treatment with chitosan on the growth of rice (Oryza sativa L.) seedlings
cv. INCA LP-5 in saline medium
Lisbel
Martínez González, Yanelis Reyes Guerrero, Dr.C. Alejandro Falcón Rodríguez,
Dra.C. Miriam Núñez Vázquez
Instituto Nacional
de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque,
Cuba. CP 32700.
RESUMEN
La quitosana es
usada ampliamente en la agricultura por su efecto fungistático, además alarga
la vida postcosecha de frutos y vegetales y estimula el crecimiento de las plantas.
Sin embargo, ha sido poco estudiado el uso de este biopolímero en la inducción
de tolerancia a la salinidad, por lo que el objetivo de este trabajo fue comprobar
si el tratamiento a las semillas con quitosana revertía los efectos inhibitorios
del estrés salino en el crecimiento de plántulas de arroz, así como en algunos
indicadores bioquímicos asociados a esta respuesta. Para ello se trataron semillas
de arroz (Oryza sativa L.) variedad INCA LP-5, durante 24 horas, con diferentes
concentraciones de quitosana (0, 100 y 500 mg L-1). Las semillas
germinadas se transfirieron a potes, a los que se les adicionó solución nutritiva
Hoagland diluida, suplementada o no con NaCl 100 mmol L-1 y se colocaron
en un cuarto de crecimiento con condiciones controladas. Las evaluaciones de
crecimiento y los indicadores bioquímicos se realizaron a los once días después
de establecido el estrés. El tratamiento a las semillas con la concentración
de 100 mgL-1 de quitosana estimuló la longitud y la masa seca de
la parte aérea de las plántulas crecidas en medio salino, así como disminuyó
los niveles de malondialdehído e incrementó los de prolina. En cuanto a la actividad
enzimática ambas concentraciones de quitosana estimularon las enzimas catalasas
y peroxidasas, siendo el efecto más notable con la concentración de 500 mg L-1.
Palabras
clave: arroz, crecimiento, quitosana, estrés salino.
ABSTRACT
The chitosan is
widely used in agriculture for having a strong fungistatic effect, also it has
other properties such as extending the post harvest life of fruits and vegetables
and stimulating the plant growth, among others. However, the use of this biopolymer
for inducing salinity tolerance has been few studied, so the objective of this
work was to check if chitosan-treated seeds are able to reverse the effects
caused by salinity in the rice seedling growth and some biochemical indicators
associated to this response. To do this, rice (Oryza sativa L.) seeds variety
INCA LP-5 were treated for 24 hours with different concentrations of chitosan
(0, 100 and 500 mg L-1). The germinated seeds were transferred to
pots containing diluted Hoagland nutritive solution supplemented or not with
NaCl 100 mmol L-1 and they were placed in a growth chamber with controlled
conditions. The growth and biochemical indicators were evaluated eleven days
after stress treatment. Seeds treated with chitosan 100 mg L-1 stimulated
shoot length and dry matter in saline medium grown seedlings and lowered malondialdehyde
and increased proline levels. Both chitosan concentrations enhanced the activities
of catalase and peroxidase enzymes, although a higher effect was obtained with
chitosan 500 mg L-1.
Key words:
rice, growth, chitosan, salt stress.
INTRODUCCIÓN
La quitosana,
es un compuesto inocuo y biodegradable, que se obtiene, fundamentalmente del
exoesqueleto de cangrejo, camarón y langosta (1, 2). Es usada por sus potencialidades
en diferentes campos que incluyen la biotecnología, la agricultura, la industria
alimenticia, y la farmacéutica (3, 4, 5).
La quitosana, ha sido ampliamente usada en la agricultura principalmente por
poseer actividad antifúngica y antimicrobiana (6, 7). Es capaz de estimular
la producción de enzimas relacionadas con respuestas defensivas en las plantas
como quitinasas, glucanasas y fenilalanina amonio liasas (PAL) (8). Se ha comprobado,
además, que estos compuestos, en dependencia de su concentración y grado de
acetilación, son capaces de activar la enzima PAL y otros componentes de la
resistencia inducida en plantas (9).
La salinidad es un estrés abiótico que causa baja productividad en la mayoría
de los cultivos en todo el mundo (10). Este estrés provoca una disminución de
la germinación y una emergencia no uniforme de las plántulas, por lo que disminuye
la densidad de población, aspecto que repercute en el establecimiento de los
cultivos. Por otra parte, se conoce que la salinidad inhibe el crecimiento de
las plantas ocasionado, en una primera fase, por la reducción en la absorción
de agua por las raíces, a lo que se le denomina fase de estrés osmótico o de
déficit hídrico (11).
Existe poca información acerca de la utilización de la quitosana para mitigar
los efectos adversos que ocasiona la salinidad en el crecimiento de las plantas
y no se tiene conocimiento de antecedentes en el cultivo del arroz. Por este
motivo, el objetivo de este trabajo fue evaluar si el tratamiento a las semillas
con quitosana era capaz de revertir los efectos adversos causados por la salinidad
en el crecimiento de plántulas de arroz de la variedad INCA LP-5, así como la
evaluación de algunos indicadores bioquímicos relacionados con esta respuesta.
MATERIALES
Y MÉTODOS
Semillas de arroz
(Oryza sativa L.) de la variedad INCA LP-5 se trataron, durante 24 horas, con
diferentes concentraciones (0, 100 y 500 mg L-1) de un polímero de
quitosana, que posee las siguientes características: masa molecular 93,3 kDa
y 31,69 % de grado de acetilación.
Posteriormente, las semillas tratadas se colocaron en placas Petri con agua
destilada para su germinación en la oscuridad a 25±2 oC. A las 48 horas, las
semillas germinadas se transfirieron a potes, a los cuales se les adicionaron
50 mL de solución nutritiva Hoagland diluida (1:2), suplementada o no con NaCl
100 mmol L-1. Se utilizaron 20 semillas por pote y seis potes por
tratamiento, es decir, 120 plántulas. Los potes se colocaron en un cuarto de
crecimiento con fotoperíodo de 12 horas y una temperatura de 24±0,2 oC.
Once días después, se midieron las longitudes de las raíces y de la parte aérea
de 25 plantas por tratamiento y se conformaron cinco muestras de cinco plantas
cada una, para evaluar la masa seca de la parte aérea y de las raíces. En este
mismo momento se realizaron algunas determinaciones bioquímicas. Para ello,
se tomaron 0,25 g de tejido fresco de cada tratamiento y se maceraron en nitrógeno
líquido, adicionándole 2,5 mL de tampón fosfato 100 mmol L-1, pH
7 y centrifugándose posteriormente a 10000 rpm por 20 minutos a 4 ºC. Con el
sobrenadante obtenido se estimó la peroxidación lipídica mediante la cuantificación
del malondialdehído (MDA) (12), la actividad de las enzimas peroxidasas totales
(13) y catalasas (14) y las proteínas solubles totales por el método de MicroLowry
(15).
Además, para la determinación del aminoácido prolina se tomaron 0,25 g de tejido
fresco de cada tratamiento y se maceraron en nitrógeno líquido, adicionándole
10 mL de agua a 100 ºC. El contenido de prolina se cuantificó por el método
de Bates (16), utilizando L-prolina (Sigma) como patrón.
El experimento se repitió en dos ocasiones con comportamientos similares. Se
muestran los resultados de una de las repeticiones. Los datos obtenidos se procesaron
estadísticamente utilizando un Análisis de Varianza de Clasificación simple
y las medias se compararon mediante el test de Rangos Múltiples de Tukey a p<0,05.
RESULTADOS
Y DISCUSIÓN
En la Figura
1 se presentan los resultados del comportamiento de las variables del crecimiento
de las plántulas de arroz cultivar INCA LP-5, crecidas tanto en solución nutritiva
sola y en solución nutritiva suplementada con NaCl. Como se puede observar,
la presencia de NaCl 100 mmol L-1 disminuyó significativamente la
longitud y la masa seca de la parte aérea; sin embargo, no tuvo efecto en las
raíces. La quitosana a la concentración de 100 mg L-1 logró una estimulación
significativa en la longitud y la masa seca de la parte aérea de aquellas plántulas
cuyas semillas fueron tratadas con el polímero (Figura
1A y C).
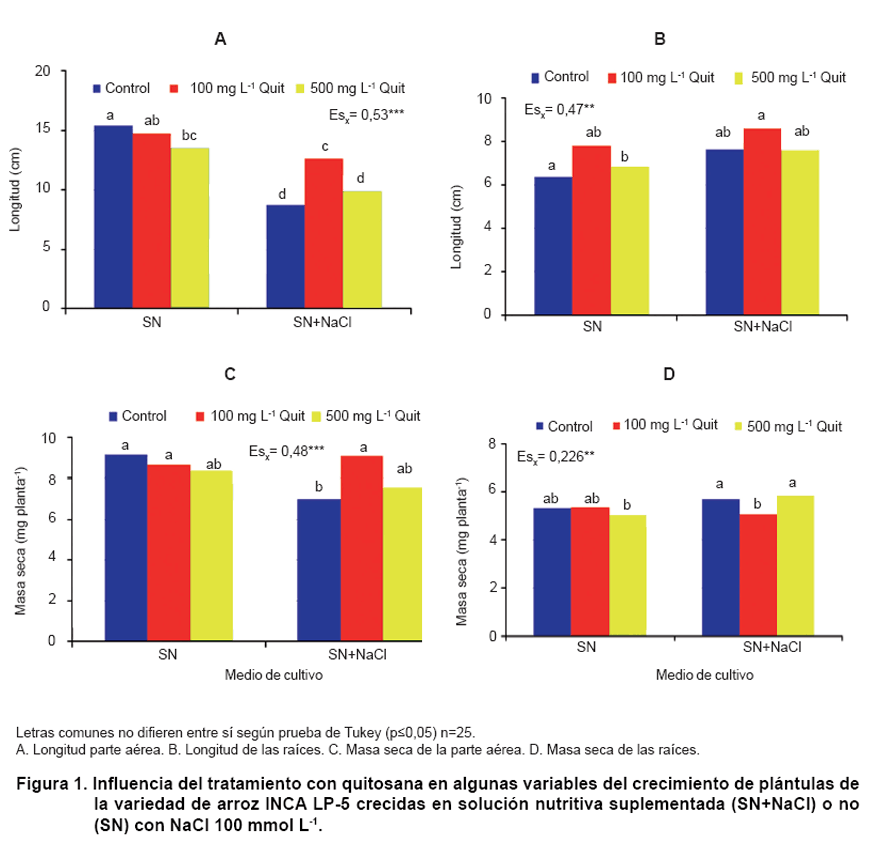
En cuanto a la masa seca de las raíces, el tratamiento con quitosana 100 mg
L-1 disminuyó esta variable en las plántulas estresadas (Figura
1D).
Es interesante destacar que el tratamiento a las semillas con quitosana no tuvo
efecto en el crecimiento de las plántulas crecidas en solución nutritiva. Este
resultado pudiera deberse a las concentraciones utilizadas, ya que se ha observado
que las concentraciones que estimulan el crecimiento son menores.
La quitosana, además, de tener efectos contra hongos patógenos, en general,
también tiene efectos promotores en el crecimiento, aunque estos se encuentran
menos estudiados. Algunos autores plantean el incremento del rendimiento de
los cultivos cuando se tratan las semillas con quitosana.
El rendimiento de fresa y arroz aumentó un 20-30 % después de la aspersión foliar
y del tratamiento a las semillas con quitosana, respectivamente (17, 18).
Al analizar el efecto de los tratamientos con quitosana a las semillas se observó
un efecto positivo de este polímero en el crecimiento de las plántulas de arroz
variedad INCA LP-5 en medio salino. Se destacó, el tratamiento de 100 mg L-1
que revirtió total y parcialmente el impacto negativo de la sal en la masa seca
y longitud de la parte aérea, respectivamente (Figura
1).
Estudios anteriores encontraron un comportamiento similar en plantas de Isabgol
(Plantago ovata Forsk) donde la quitosana (0,2 %) estimuló la longitud del tallo
y las raíces y la masa seca de estas últimas en condiciones de estrés salino
(19). Con la aplicación de quitosana a plántulas de soya bajo estrés salino
se observaron, también, incrementos en la masa seca de las mismas (20).
Igualmente el tratamiento a las semillas de cártamo (Carthamus tinctorius L.)
con quitosana incrementó el crecimiento de las plántulas en condiciones de déficit
hídrico (20). Algo similar informaron Zeng y Luo, quienes encontraron que el
recubrimiento de las semillas con quitosana incrementó la velocidad de germinación
y el crecimiento de plantas de trigo en condiciones de sequía (21).
Otros autores han informado que al tratar semillas de maíz con quitosana 0,50
% se mejora la velocidad de germinación y se incrementa la longitud y la masa
seca de la raíz y el tallo de las plántulas sometidas a estrés de temperaturas
bajas (22).
El malondialdehído (MDA) es uno de los productos finales de baja masa molecular
de la descomposición de los hidroperóxidos lipídicos. Este compuesto es el más
utilizado como medida de la peroxidación lipídica en la membrana celular.
Como se puede observar en la Figura
2A, las plántulas crecidas en solucion nutritiva con NaCl mostraron mayores
niveles de MDA. Este aumento de la concentración de MDA ante diferentes tipos
de estrés está ampliamente descrito en la literatura (23, 25) y es una consecuencia
directa de la acción de las especies reactivas de oxígeno (EAO).
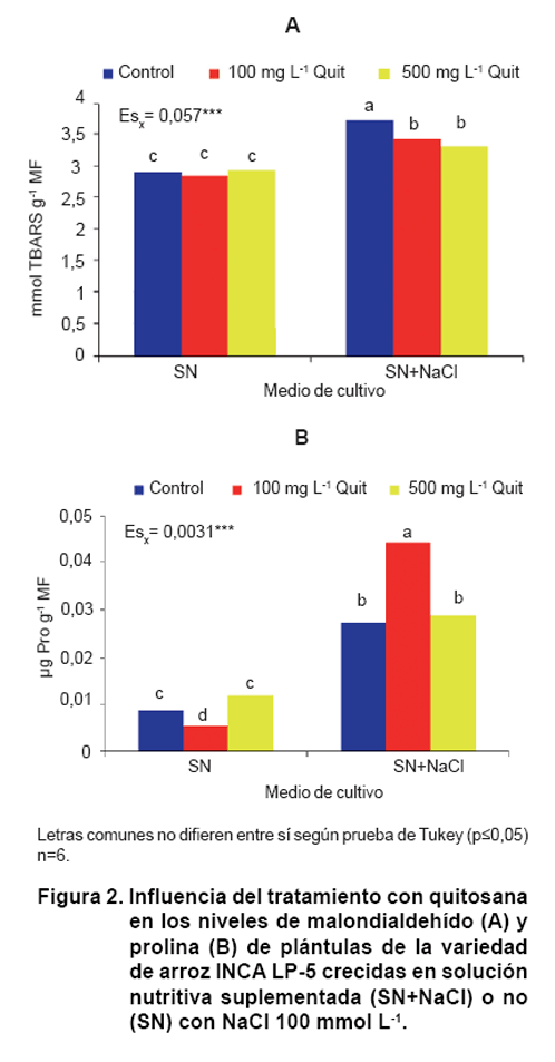
El tratamiento
a las semillas con ambas concentraciones de quitosana disminuyó los niveles
de MDA en las plántulas estresadas. Resultados similares han sido informados
por otros autores en plantas de girasol (26). También, se ha observado la disminucion
del contenido de MDA en plantulas de tomate asperjadas foliarmente con quitosana
150 mg L-1 y sometidas a estrés salino (27). Además el pretratamiento
con oligoquitosana 0,0625 %, también disminuyó los niveles de MDA en plantas
de trigo crecidas en condiciones de salinidad (28).
Igualmente, concentraciones de quitosana (hasta 0,5 %) disminuyeron los niveles
de MDA en plántulas de cártamo sometidas a estrés osmótico (20). En condiciones
de bajas temperaturas el tratamiento con quitosana también disminuyó el contenido
de MDA en plantas de maíz (22).
Las plantas superiores pueden acumular L-prolina (Pro) en respuesta a diversos
estrés medioambientales. En este experimento el estrés salino aumentó la concentración
de este aminoácido en las plántulas de arroz con respecto al control. El tratamiento
con quitosana a la concentración de 100 mg L-1 aumentó aún más estos
niveles. Nótese, que esta misma concentración disminuyó significativamente este
indicador en las plántulas no estresadas.
Aunque el papel exacto de la prolina en el estrés salino es controversial, puesto
que no siempre los aumentos de este aminoácido han correlacionado con mayor
tolerancia al estrés (29), en los últimos años se ha demostrado que la aplicación
exógena de prolina proporciona una acción protectora contra el daño oxidativo
inducido por el estrés salino (30, 32).
Además, se ha demostrado que la acumulación de prolina estabiliza las membranas
y los componentes subcelulares, incluyendo el complejo II de la cadena de transporte
electrónico mitocondrial. Existen estudios que proponen a la prolina como aceptor
final de los radicales libres (33) y estabilizador del potencial redox por reaprovisionamiento
de la provisión de NADP+ (34).
Los resultados de este trabajo mostraron que el tratamiento con quitosana aumentó
los niveles de prolina en condiciones salinas; sin embargo, solamente la concentración
de 100 mg L-1 incrementó significativamente este indicador con relación
al tratamiento control. Un incremento de la prolina ha sido encontrado en plantas
de tomate y trigo sometidas a estrés salino (27, 28); mientras que en plantas
de girasol el tratamiento a las semillas con quitosana produjo un efecto contrario
(26).
La concentración de proteínas totales disminuyó con el estrés salino y el tratamiento
con quitosana agudizó este comportamiento (Figura
3A). Contrario a este resultado se encontró que el tratamiento con bajas
concentraciones de quitosana a plántulas de cártamo sometidas a estrés hídrico
aumentó la concentración de proteínas solubles (20).
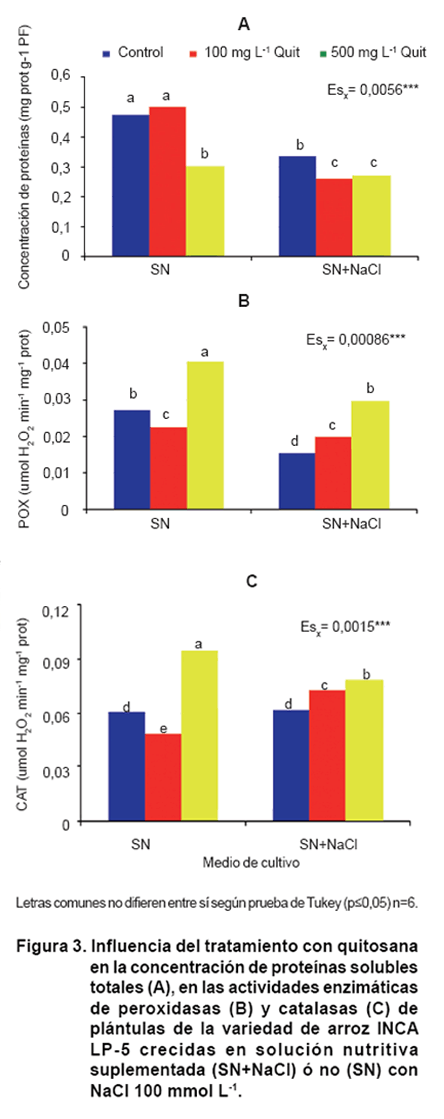
Es interesante notar cómo el tratamiento con el polímero a la concentración
de 500 mg L-1 en las plántulas no estresadas disminuyó también el
contenido de proteínas. Resultados similares se encontraron en plántulas de
cártamo provenientes de semillas tratadas con quitosana (20).
Entre las principales enzimas que remueven oxidantes tóxicos se encuentran las
peroxidasas y las catalasas.
En la Figura 3 (B y C)
se puede observar que el estrés salino, en el caso del tratamiento control,
disminuyó la actividad de las enzimas peroxidasas (POX) y no tuvo influencia
en las catalasas (CAT).
El tratamiento con quitosana aumentó la actividad de ambas enzimas en las plántulas
estresadas y este efecto fue dependiente de la concentración. Es interesante
señalar que en las plántulas no estresadas la concentración de 100 mg L-1
disminuyó ambas actividades enzimáticas; sin embargo, la concentración de 500
mg L-1 aumentó significativamente la actividad de estas enzimas.
Esto pudiera deberse a que una concentración mayor, pondría a la célula en estado
de alerta, potenciando las defensas.
Existen numerosos estudios sobre los efectos del estrés salino en las enzimas
antioxidantes de las plantas, pero estos, en ocasiones, son contradictorios.
En cuanto a las peroxidasas, el estrés salino aumenta la actividad de esta enzima
en plantas de arroz (23, 35, 36). La actividad de las peroxidasas de callos
de papa se incrementó bajo estrés salino, pero a altas concentraciones (NaCl
150 mmol L-1) esta actividad disminuyó (37). Igualmente, en algodón,
se ha informado que las POX se incrementan en los cultivos tolerantes a la sal
y se reduce o permanece constante en los sensibles a dicho estrés (38, 40).
Sin embargo, en trigo, la salinidad disminuyó la enzima POX, además de aumentar
los niveles de MDA y la producción del radical superóxido (41), similar a lo
obtenido en este trabajo.
En el caso de la enzima catalasa ocurre algo similar, pues algunos autores han
encontrado estimulación de la actividad de esta enzima a través de la activación
de los genes Cat2 y Cat3 (42). Sin embargo, otros autores encontraron disminución
en la CAT en hojas de arroz por tratamiento con NaCl (43, 44). Por otra parte,
también se ha observado que esta enzima no varía ante estrés salino en plántulas
de arroz (45).
En cuanto a la estimulación de la actividad enzimática de la CAT por el tratamiento
con quitosana se han obtenido resultados similares en plántulas de tomate asperjadas
con quitosana y sometidas a estrés salino (27). También en plántulas de trigo
tratadas con oligoquitosanas y sometidas a estrés se encontraron aumentos de
las actividades enzimáticas de las POX, CAT y superóxidos dismutasas (SOD) (28).
Sin embargo, en condiciones normales se ha encontrado estimulación de la actividad
POX y CAT en plántulas de girasol después del tratamiento con quitosana, pero
en condiciones salinas estas mismas concentraciones causaron disminución de
ambas actividades enzimáticas (26).
Además, se ha encontrado que el tratamiento con quitosana estimula la actividad
enzimática antioxidante en plantas sometidas a otros tipos de estrés como temperaturas
bajas en plantas de maíz (22) y estrés hídrico en plantas de trigo (21).
Recientemente, la quitosana ha recibido una especial atención por su capacidad
como antioxidante, la cual depende de la masa molecular y del grado de acetilación
(46). Varios estudios han confirmado que la quitosana puede tener potencial
como atrapadora de radicales libres (46, 47).
Este compuesto puede atrapar el radical hidroxilo y el superóxido y ha sido
informado que tiene propiedades protectoras del ADN (48). El mecanismo por el
cual actúa la quitosana pudiera atribuirse a su estructura con un gran número
de grupos hidroxilo y aminos disponibles para reaccionar con las especies activas
de oxigeno EAO (49).
De forma general, el tratamiento con quitosana produjo la activación de las
enzimas antioxidantes POX y CAT en plántulas crecidas en medio salino, con lo
que disminuyó la peroxidación lipídica en la membrana. Por otra parte, aunque
la quitosana también incrementó los niveles de prolina en las plántulas crecidas
en medio salino, solamente la concentración de 100 mg L-1 indujo
un incremento que se diferenció estadísticamente del resto de los tratamientos,
coincidiendo con la concentración que revirtió la inhibición que la salinidad
produjo en el crecimiento de la parte aérea de las plántulas, lo que sugiere
la importancia de este metabolito en estas condiciones, ya que es conocido que
la prolina puede actuar como antioxidante y como soluto osmóticamente activo.
Teniendo en cuenta, que estos son los primeros resultados que se obtienen del
efecto de la quitosana en el crecimiento de plántulas de arroz en medio salino
y muy particularmente, en la variedad INCA LP-5, se sugiere continuar profundizando
en estos estudios, sobre todo, si se considera la importancia que tiene esta
variedad en la producción cubana de arroz y el incremento cada vez mayor que
existe de áreas afectadas por la salinidad.
BIBLIOGRAFÍA
1. Ramírez, M.
A.; Cabrera, G.; Gutiérrez, A. y Rodríguez, T. Metodología de obtención de quitosana
a partir de quitina de langosta. Cultivos Tropicales, 2000, vol. 21, no. 1,
pp. 81-84. ISSN 1819-4087.
2. El Hadrami, A.; Adam, L. R.; El Hadrami, I. y Daayf , F. Chitosan in Plant
Protection. Marine Drugs, 2010, vol. 8, pp. 968-987. ISSN 1660-3397.
3. Lárez, C. Algunas potencialidades de la quitina y el quitosano para usos
relacionados con la agricultura en Latinoamérica. Revista UDO Agrícola, 2008,
vol. 8, no. 1, pp. 1- 22. ISSN 1317-9152.
4. Xia, W.; Liu, P.; Zhang, J. y Chen, J. Biological activities of chitosan
and chitooligosaccharides. Food Hydrocolloids, 2011, vol. 25, no. 2, pp. 170--179.
ISSN 0268-005X.
5. Dutta, J.; Tripathi, S. y Dutta, P. K., Progress in antimicrobial activities
of chitin, chitosan and its oligosaccharides: a systematic study needs for food
applications. Food Science and Technology International, 2012, vol.18, no. 1,
pp. 3-34. ISSN 1532-1738.
6. Falcón, A.; Cabrera, J. C.; Costales, D.; Ramírez, M. A.; Cabrera, G.; Toledo,
V. y Martínez-Téllez, M. A. The effect of size and acetylation degree of chitosan
derivatives on tobacco plant protection against Phytophthora parasitica. World
Journal of Microbiology and Biotechnology, 2008, vol. 24, pp. 103-112. ISSN
1573-0972.
7. Yin, H.; Zhao, X. y Du, Y. Oligochitosan: A plant diseases vaccine. A review.
Carbohydrate Polymers, 2010, vol. 82, pp. 1-8. ISSN 0144-8617.
8. Hongyin, Z.; Renping, L. y Weimin, L. Effects of Chitin and Its Derivative
chitosan Postharvest Decay of Fruits: A Review. Int. J. Mol. Sci., 2011, vol.
12, pp. 917-934. ISSN 1422-0067.
9. Falcón Rodríguez, A. B.; Costales, D.; Cabrera, J. C. y Martínez Téllez,
M. A. Chitosan physico-chemical properties modulate defense responses and resistance
in tobacco plants against the oomycete Phytophthora nicotianae. Pestic. Biochem.
Physiol., 2011, vol. 100, p. 221-228. ISSN 0048-3575.
10. Álvarez, A.; Baños , R. y Otero, L. Salinidad y uso de aguas salinas para
la irrigación de cultivos y forrajes en Cuba. Ciencia y Tecnología Ganadera,
2008, vol. 2, no. 1, pp. 1-12. ISSN 1998-3050.
11. Munns, R. y Tester, M. Mechanisms of salinity tolerance. Annual Review of
Plant Biology, 2008, vol. 59, pp. 651-681. ISSN 1543-5008.
12. Hodges, M. D.; DeLong, J. M.; Forney, C. F. y Prange, R. K., Improving the
thiobarbituric acid-reactive-substances assay for lipid peroxidation in plant
tissues containing anthocyanin and other interfering compounds. Planta, 1999,
vol. 207, pp. 604-611. ISSN 1432-2048.
13. Bergmeyer, H. U. Peroxidase, in Methods of Enzymatic Analysis. H.U. Bergmeyer,
Editor. Academic Press Inc.: New York y London. 1974, pp. 685-690. ISBN 978-0-12-091302-2.
14. Aebi, H. Catalase in vitro. Methods in Enzymology, 1984, vol. 105, pp. 121-126.
ISSN 0076-6879.
15. Sun, S. MicroLowry in methods in Plant Molecular Biology and Agricultural
Biotechnology. Asian Vegetable Research and Development Center Council of Agriculture,
1994, pp. 9-11. ISSN 0252-1542.
16. Bates, L. S.; Waldren, R. P. y Teare, I. D. Rapid determination of free
proline for water stress studies. Plant Soil, 1973, vol. 39, pp. 205-207. ISSN
1573-5036.
17. Abdel-Mawgoud, A. M. R.; Tantawy, A. S.; El-Nemr, M. A. y Sassine, Y. N.
Growth and Yield Responses of Strawberry Plants to Chitosan Application. European
Journal of Scientific Research, 2010, vol. 39, no.1, pp. 161. ISSN 1450-202X.
18. Boonlertnirun, S.; Boonraung, C. y Suvanasara, R. Application of Chitosan
in Rice Production. Journal of Metals, Materials and Minerals, 2008, vol. 18,
no. 2, pp. 47-52. ISSN 1543-1851.
19. Mahdavi, B. Seed germination and growth responses of Isabgol (Plantago ovata
Forsk) to chitosan and salinity. International Journal of Agriculture and Crop
Sciences, 2013, vol. 5, no. 10, pp. 1084-1088. ISSN 2227-670X.
20. Mahdavi, B.; Sanavy, S. A. M. M.; Aghaalikhani, M.; Sharifi, M. y Dolatabadian,
A. Chitosan Improves Osmotic Potential Tolerance in Safflower (Carthamus tinctorius
L.) Seedlings. Journal of Crop Improvement, 2011, vol. 25, no. 6, pp. 728-741.
ISSN 1542-7536.
21. Zeng, D. y Luo, X. Physiological Effects of Chitosan Coating on Wheat Growth
and Activities of Protective Enzyme with Drought Tolerance. Open Journal of
Soil Science, 2012, vol. 2, pp. 282-288. ISSN 2162-5379.
22. Guan, Y.-J.; Hu, J.; Wang, X.-J. y Shao, C.-X. Seed priming with chitosan
improves maize germination and seedling growth in relation to physiological
changes under low temperature stress. Journal of Zhejiang University Science
B., 2009, vol. 10, no. 6, pp. 427-433. ISSN 1862-1783.
23. Khan, M. H. y Panda, S. K. Alterations in root lipid peroxidation and antioxidative
responses in two rice cultivars under NaCl-salinity stress. Acta Physiologiae
Plantarum, 2008, vol. 30, pp. 81-89. ISSN 1861-1664.
24. Soleimanzadeh, H.; Habibi, D.; Ardakani, M. R.; Paknejad, F. y Rejali, F.
Effect of Potassium Levels on Antioxidant Enzymes and Malondialdehyde Content
under Drought Stress in Sunflower (Helianthus annuus L.). American Journal of
Agricultural and Biological Sciences, 2010, vol. 5, no. 1, pp. 56-61. ISSN 1557-4997.
25. Juvany, M.; Müller, M. y Munné-Bosch, S. Photo-oxidative stress in emerging
and senescing leaves: a mirror image?. Journal of Experimental Botany, 2013,
vol. 64, no. 11, pp. 3087-3098. ISSN 1460-2431.
26. Jabeen, N. y Ahmad, R. The activity of antioxidant enzymes in response to
salt stress in safflower (Carthamus tinctorius L.) and sunflower (Helianthus
annuus L.) seedlings raised from seed treated with chitosan. J. Sci. Food Agric.,
2013, vol. 93, no. 7, pp. 1699-1705. ISSN 1097-0010.
27. LiQiang, G. Effects of chitosan on physiological characteristics of tomato
seedlings under salt stress. Agricultural Science & Technology - Hunan,
2012, vol. 13, no.3, pp. 551-553. ISSN 1009-4229.
28. Ma, L.; Li, Y.; Yu, C.; Wang, Y.; Li, X.; Li, N.; Chen, Q. y Bu, N. Alleviation
of exogenous oligochitosan on wheat seedlings growth under salt stress. Protoplasma,
2012, vol. 249, no. 2, pp. 393. ISSN 1615-6102.
29. Kong-Ngern, K.; Bunnag, S. y Theerakulpisut, P. Proline, hydrogen peroxide,
membrane stability and antioxidant enzyme activity as potential indicators for
salt tolerance in rice (Oryza sativa L.). International Journal of Botany, 2012,
vol. 8, no. 2, pp. 54-65. ISSN 1811-9700.
30. Nounjan, N. y Theerakulpisut, P. Effects of exogenous proline and trehalose
on physiological responses in rice seedlings during salt-stress and after recovery.
Plant, Soil and Environment, 2012, vol. 58, no. 7, pp. 309-315. ISSN 1805-9368.
31. Hossain, M. A. y Fujita, M. Evidence for a role of exogenous glycinebetaine
and proline in antioxidant defense and methylglyoxal detoxification systems
in mung bean seedlings under salt stress. Physiology and Molecular Biology of
Plants, 2010, vol. 16, pp. 19-29. ISSN 0974-0430.
32. Huang, Y.; Bie, Z.; Liu, Z.; Ai, Z. y Wang, W. Protective role of proline
against salt stress is partially related to the improvement of water status
and peroxidase enzyme activity in cucumber. Soil Science and Plant Nutrition,
2009, vol. 55, pp. 698-704. ISSN 1747-0765.
33. Sharma, S. S. y Dietz, K. J. The significance of amino acids and amino acid-derived
molecules in plant responses and adaptation to heavy metal stress. Journal of
Experimental Botany, 2006, vol. 57, pp. 711-726. ISSN 1460-2431.
34. Hamilton, E. W. y Heckathorn, S. A. Mitochondrial adaptations to NaCl. Complex
I is protected by anti-oxidants and small heat shock proteins, whereas complex
II is protected by proline and betaine. Plant Physiology, 2001, vol. 126, pp.
1266-1274. ISSN 1532-2548.
35. Panda, S. K. y Khan, M. H. Salt stress influences lipid peroxidation and
antioxidants in the leaf of an indica rice (Oryza sativa L). Physiology and
Molecular Biology of Plants, 2003, vol. 9, pp. 273-278. ISSN 0974-0430.
36. Özdemir, F.; Bor, M.; Demiral, T. y Turkan, I. Effects of 24-epibrassinolide
on seed germination, seedling growth, lipid peroxidation, proline content and
antioxidative system of rice (Oryza sativa L.) under salinity stress. Plant
Growth Regulation, 2004, vol. 42, pp. 203-211. ISSN 1573-5087.
37. Rahnama, H. y Ebrahimzadeh, H. Antioxidant isozymes activities in potato
plants (Solanum tuberosum L.) under salt stress. Journal of Sciences, Islamic
Republic of Iran, 2006, vol. 17, no. 3, pp. 225-230. ISSN 1016-1104.
38. Gossett, D. R.; Millhollon, E. P. y Lucas, M. C. Antioxidant response to
NaCl stress in salt-tolerant and salt-sensitive cultivars of cotton. Crop Science,
1994, vol. 34, no. 3, pp. 706-714. ISSN 1435-0653.
39. Rajguru, S. N.; Banks, S. W.; Gossett, D. R.; Lucas, M. C.; Fowler, T. E.
J. y Millhollon, E. P. Antioxidant Response to Salt Stress During Fiber Development
in Cotton Ovules. Journal of Cotton Science, 1999, vol. 3, pp. 11-18. ISSN 1524-3303.
40. Meloni, D. A.; Oliva, M. A.; Martinez, C. A. y Cambraia, J. Photosynthesis
and activity of superoxide dismutase, peroxidase and glutathione reductase in
cotton under salt stress. Environmental and Experimental Botany, 2003, vol.
49, no. 1, pp. 69-76. ISSN 0098-8472.
41. Zheng, C.; Jiang, D.; Liu, F.; Dai, T.; Jing, Q. y Cao, W. Effects of salt
and waterlogging stresses and their combination on leaf photosynthesis, chloroplast
ATP synthesis, and antioxidant capacity in wheat. Plant Science, 2009, vol.
176, pp. 575-582. ISSN 0168-9452.
42. Savouré, A.; Thorin, D.; Davey, M.; Hua, X. J.; Mauro, S.; Van Montagu,
M.; Inzé, D. y Verbruggen, N. NaCl and CuSO4 treatments trigger distinct oxidative
defence mechanisms in Nicotiana plumbaginifolia L. Plant, Cell & Environment,
1999, vol. 22, pp. 387-396. ISSN 1365-3040.
43. Dionisio-Sese, M. L. y Tobita, S. Antioxidant responses of rice seedlings
to salinity stress. Plant Science, 1998, vol. 135, pp. 1-9. ISSN 0168-9452.
44. Lee, D. H.; Kim, Y. S. y Lee, C. B. The inductive responses of the antioxidant
enzymes by salt stress in the rice (Oryza sativa L.). Plant Physiology, 2001,
vol. 158, pp. 737-745. ISSN 1532-2548.
45. Fadzilla, N. M.; Finch, R. P. y Burdon, R. H. Salinity, oxidative stress
and antioxidant responses in shoot cultures of rice. Journal of Experimental
Botany, 1997, vol. 48, pp. 325-331. ISSN 1460-2431.
46. Kim, K. W. y Thomas, R. L. Antioxidative activity of chitosans with varying
molecular weights. Food Chem., 2007, vol. 101, pp. 308-313. ISSN 0308-8146.
47. Yen, M. T.; Yang, J. H. y Mau, J. L. Antioxidant properties of chitosan
from crab shells. Carbohydr. Polym., 2008, vol. 74, pp. 840-844. ISSN 0144-8617.
48. Harish Prashanth, K. V.; Dharmesh, S. M.; Jagannatha Rao, K. S. y Tharanathan,
R. N. Free radical-induced chitosan depolymerized products protect calf thymus
DNA from oxidative damage. Carbohydr. Res., 2007, vol. 342, pp. 190-195. ISSN
0008-6215.
49. Feng, Y.; Jingjiang, H.; Jianlong, L.; Xiaoling , W. y Yurong, Q. Chitosan
enhances leaf membrane stability and antioxidant enzyme activities in apple
seedlings under drought stress. Plant Growth Regul., 2009, vol. 58, p. 131-136.
ISSN 1573-5087.
Recibido: 2 de
octubre de 2014
Aceptado: 26 de enero de 2015
Lisbel Martínez
González, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal
1, San José de las Lajas, Mayabeque, Cuba. CP 32700. Email: lisbel@inca.edu.cu


