Alternativa
de la técnica de tinción para determinar la colonización
micorrízica
Alternative
stainning technique to determine mycorrhizal colonization
Dra.C.
JYakelín Rodríguez Yon, Lianne Arias Pérez, Aida Medina
Carmona, Ms.C. Yonaisy Mujica Pérez, Ms.C. Laura R. Medina García,
Dra.C. Kalyanne Fernández Suárez, Ms.C. Aracely Mena Echevarría
Instituto Nacional
de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las
Lajas, Mayabeque, Cuba, CP 32700.
RESUMEN
La técnica
de tinción de raíces es necesaria en el trabajo con los hongos
micorrizógenos arbusculares (HMA), que constituyen la base de algunos
biofertilizantes, como EcoMic®, cada vez más utilizados en las prácticas
agrícolas a nivel mundial. Cada año se incrementa el número
de muestras a evaluar en los laboratorios de micorrizas de los distintos centros
de investigaciones científicas, de enseñanza e incluso de algunos
vinculados a la producción, cuya labor requiere de la aplicación
de dicha técnica. Sin embargo, ésta tiene el inconveniente de
utilizar reactivos cancerígenos y altamente tóxicos, por lo que
fue objetivo de este trabajo sustituir los mismos por otros no nocivos a la
salud humana y al medio ambiente. Tal es el caso del azul de tripano, que fue
sustituido por la tinta de bolígrafo Parker QuinK lavable en agua. Se
eliminó además del protocolo el ácido láctico y
la glicerina. Los resultados demostraron la pertinencia de las modificaciones
realizadas y revelaron la utilidad y alta calidad de la tinta mencionada, la
cual tiñe exitosamente todas las estructuras fúngicas, permitiendo
visualizarlas claramente durante un periodo de tiempo prolongado.
Palabras
clave: micorrizas arbusculares, raíces, colorantes, protección
de la salud.
ABSTRACT
The root stainning
technique is neccesary in the work with arbuscular mycorrhizal fungi (AMF),
which constitute the base of several Biofertilizers, as the EcoMic®
product, each time more used on agricultural practices at world level. That`s
why the sample number evaluated at Mycorrhiza laboratories from diverse Research,
Academic and even some productive Centers, increases every year. Those works
require the application of such technique; nevertheless, it has the inconvenient
to use highly toxic and carcinogenic reagents. The objective of the present
work was to substitute those reagents by others non harmful to human health
and environment. This is the case of Trypan blue that was substituted by the
washable pen ink Parker QuinK. Moreover, Lactic acid and Glycerin were eliminated
from the protocol. Results showed the pertinence of such modifications and revealed
the usefulness and high quality of mentioned ink, which successfully stains
all fungal structures allowing a clear visualization during long time.
Key words:
arbuscular mycorrhiza, roots, colorants, health protection.
INTRODUCCIÓN
Los hongos micorrizógenos
arbusculares (HMA) forman una asociación simbiótica con más
del 85 % de las plantas terrestres y como resultado ambas partes obtienen beneficios
mutuos para su crecimiento y desarrollo (1). Cabe destacar los resultados satisfactorios
en la mejora del estado nutritivo de las plantas y en el incremento del rendimiento
agrícola, obtenidos con la inoculación de estos microorganismos
a diferentes cultivos de interés económico, en varios países
latinoamericanos, incluido Cuba (2). Por ello, las investigaciones en el establecimiento
y funcionamiento de esta asociación en los ecosistemas naturales y en
los agroecosistemas, son fundamentales. Por tanto, es necesario disponer de
técnicas apropiadas que permitan cuantificar la colonización intrarradical
de estos hongos.
Con este propósito se desarrolló un método de tinción
de las estructuras de los HMA en las raíces que utiliza el azul de tripano
(3). Este reactivo es considerado carcinógeno, según la Agencia
Internacional para Investigaciones sobre el Cáncer (4). También
se emplean con frecuencia otras técnicas basadas en el uso de presuntos
carcinógenos como el clorazol negro E (5) y la fucsina ácida (6).
La utilización de tales químicos debe ser reducida por razones
de salud y seguridad del personal involucrado pues pueden causar irritación
de la piel y sus vapores pueden irritar ojos, nariz, garganta y pulmones (7).
Asimismo, por razones ambientales es preferible, siempre que sea posible, encontrar
sustitutos para químicos nocivos.
En la tentativa de eliminar algunos de estos compuestos peligrosos, se desarrolló
un método simple, confiable y económico para teñir las
estructuras fúngicas de interés en el tejido radical y determinar
la colonización micorrízica (8). Esta técnica sustituye
químicos carcinogénicos potenciales, usados convencionalmente,
por tinta de bolígrafo no lavable en agua que es inofensiva. No obstante,
el tinte carcinogénico azul de tripano es comúnmente usado aún
por la mayoría de los micorrizólogos del mundo, incluido el laboratorio
de Micorrizas del INCA.
El objetivo del presente trabajo fue adecuar la técnica descrita para
su uso masivo en las condiciones de diversos laboratorios (8), con énfasis
en la sustitución de reactivos nocivos para la salud y el medio ambiente
por otros no tóxicos pero igualmente efectivos.
MATERIALES
Y MÉTODOS
Material
biológico
Se utilizaron raíces frescas de características diferentes a partir
de distintas familias de plantas (maíz [Zea mays L.], tomate
[Solanum lycopersicum L.] y pepino [Cucumis sativus L.]).
Las mismas se recibieron en el laboratorio de Micorrizas arbusculares del INCA
para su procesamiento. Como inóculos de HMA se emplearon dos cepas de
la colección del INCA: Funneliformis mosseae [(Nicol. &
Gerd.) Walker & Schüßler] (9) y Glomus cubense (Y. Rodr.
& Dalpé) (10), INCAM-2 e INCAM-4, respectivamente; así como
un conglomerado de HMA nativos (11) pertenecientes a los géneros Glomus
(10 morfotipos), Funneliformis (2), Rhizoglomus (4), Sclerocystis
(1), Septoglomus (1), Claroideoglomus (3), Acaulospora
(5), Gigaspora (1) y Scutellospora (1), según la clasificación
de los Glomeromycota (12, 13). La inoculación en todos los casos se realizó
en el momento de la siembra. Se procesaron raíces inoculadas y no inoculadas
como control.
Preparación de las soluciones de tinción a base
de tinta
Se partió de varias tintas de bolígrafo de colores azul y negro
para preparar la solución de tinción: Pelikan azul 523, no lavable
en agua, China; Kores azul, tinta para tampón; Staedtler azul 745, Alemania;
Fluido azul para corrección, China; Parker Quink azul lavable en agua,
Inglaterra; Parker negra, Inglaterra; Musso negra, tinta para sellar sin aceite.
Las mismas se prepararon a razón de 25 mL de tinta en 1000 mL de ácido
clorhídrico (1N) al 2,5 % (v/v).
Determinación de la colonización micorrízica intrarradical
Las raíces se lavaron cuidadosamente con agua común y se secaron
en estufa a 70 °C hasta peso constante. Para cada especie vegetal se tiñeron,
por separado, varios grupos de 200 mg de raíces secundarias, según
los distintos protocolos, procesando 20 réplicas por tratamiento en cada
uno de ellos. El primero radicó en la tinción mediante el procedimiento
estándar que utiliza el azul de tripano (3) y el segundo fue el desarrollado
en este trabajo que consistió en clarificar las raíces en solución
de hidróxido de potasio al 10 % (m/v) incubando en estufa a 90 oC
de 30 minutos a una hora y luego se eliminó la solución lavando
varias veces con abundante agua corriente. Posteriormente se añadió
la solución de tinción, se dejó en reposo por 15 minutos
a temperatura ambiente y a continuación se colocó en la estufa
de 10 a 15 minutos a 70 oC. Este último protocolo se realizó
repetidamente en correspondencia con el número de las soluciones de tinción
que se seleccionaron para desarrollar la técnica.
La lectura de las muestras se realizó en estereoscopio (Carl Zeiss, Stemi
2000-C/50x). A partir de las lecturas se determinaron los porcentajes de colonización
micorrízica y la intensidad, según metodología descrita
en el Manual de ProcedimientosA. Se montaron preparaciones de fragmentos
de raicillas teñidas y se realizaron observaciones al microscopio óptico
(Carl Zeiss, Axiostar Plus) para seleccionar la solución de tinción
con mejores resultados en cuanto a la nitidez al visualizar las estructuras
fúngicas.
Análisis estadístico
Los valores de porcentajes de colonización micorrízica e intensidad,
obtenidos mediante la evaluación por ambos protocolos (método
estándar y la tinta con mejores resultados) se compararon mediante una
Prueba T de Student para muestras relacionadas, utilizando el paquete SPSS Versión
21 para Windows.
RESULTADOS
Y DISCUSIÓN
Las soluciones
de tinción que se prepararon a partir de las tintas: Pelikan azul 523
no lavable en agua y fluido azul para corrección, ambas de procedencia
china, así como Kores azul y Staedtler azul 745 alemana, resultaron en
la formación de precipitados y cambiaron de coloración cuando
se les añadió el ácido clorhídrico, por lo que no
se seleccionaron para ser utilizadas en los ensayos de la técnica, pues
podían entorpecer la visualización de las estructuras fúngicas
en la posterior observación al estereoscopio, considerándose no
útiles para este fin.
Las dos tintas negras ensayadas tiñeron las estructuras intrarradicales
y extrarradicales de los HMA y posibilitaron su observación al estereoscopio,
rindiendo mejores resultados, en cuanto a la nitidez en la visualización
de las estructuras fúngicas, la Parker en comparación con la Musso.
La utilidad de la tinta negra encontrada en este trabajo concuerda con resultados
previos donde se informó como mejor alternativa para este propósito
la tinta de bolígrafo Shaeffer negra no lavable en agua (8).
A diferencia del trabajo mencionado (8), en el presente estudio se logró
obtener un mayor contraste cuando se utiliza la tinta azul Parker Quink. Además,
con esta tinta, si la muestra queda sobreteñida se debe esperar unos
días antes de la lectura y las raíces se pueden conservar en la
solución de tinción a temperatura ambiente durante seis meses
aproximadamente. En caso de que la lectura se realice meses después dentro
de este periodo y presente dificultades para visualizar las estructuras fúngicas
debe procederse a calentar las muestras en estufa por 10 minutos a 70 oC.
Se resalta la tinta Parker Quink azul lavable en agua, la cual tiñó
las muestras y permitió visualizar con excelente claridad todas las estructuras
fúngicas dentro y fuera de las raíces procedentes de las diferentes
familias de plantas como se aprecia en la figura.
Esta tinta resultó la más apropiada para utilizar como colorante,
en sustitución del azul de tripano, en la técnica desarrollada
comúnmente para la tinción de las estructuras de los HMA (3),
por lo que se recomienda para una mayor calidad en la fotodocumentación
y para facilitar la propia evaluación al microscopio. La misma permitió
distinguir muy fácilmente las raíces colonizadas de las no colonizadas
(fotos a, b). Las hifas
individuales en secciones de raíces con colonización micorrízica
parcial o abundante se observaron claramente (fotos
d, f). Esta tinción permitió la visualización clara
de las vesículas, esporas germinadas e hifas intra y extrarradicales
con estructuras de penetración (fotos
b-f).
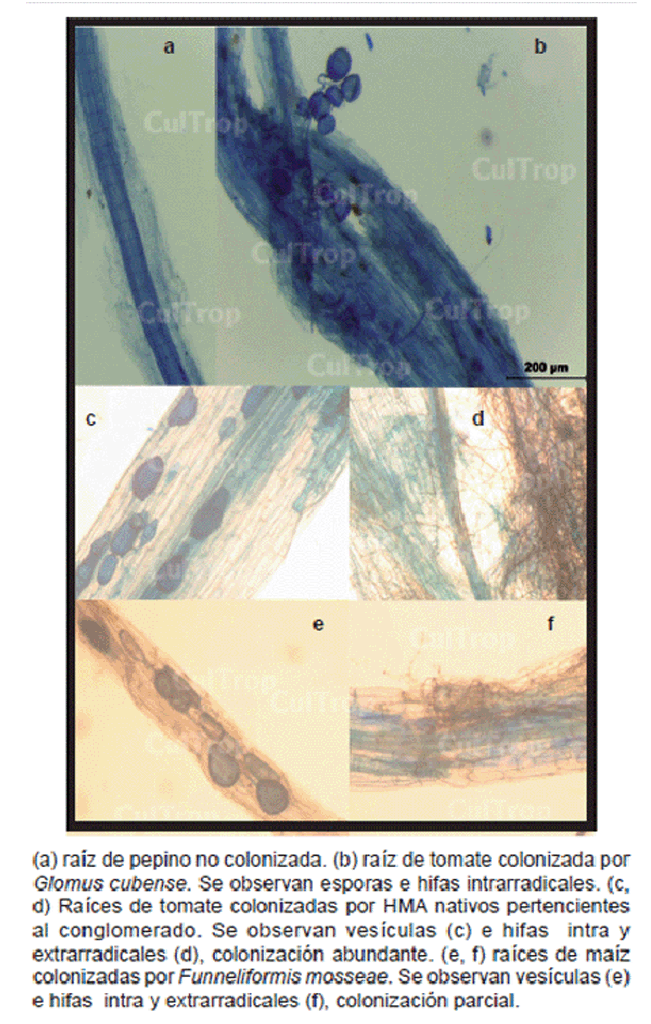
En las figuras se puede
apreciar que las soluciones de tinción ensayadas tiñeron por igual
las estructuras fúngicas de los diferentes hongos inoculados. Los mismos
son representativos de dos órdenes (Glomerales y Diversisporales), cuatro
familias (Glomeraceae, Claroideoglomeraceae, Gigasporaceae
y Acaulosporaceae) y nueve géneros representados fundamentalmente,
por especies de Glomus, Acaulospora, Rhizoglomus,
Funneliformis y Claroideoglomus, entre otros. Lo antes mencionado
demuestra la magnitud del alcance de la técnica alternativa propuesta
con la utilización de la tinta azul Parker Quink lavable como colorante.
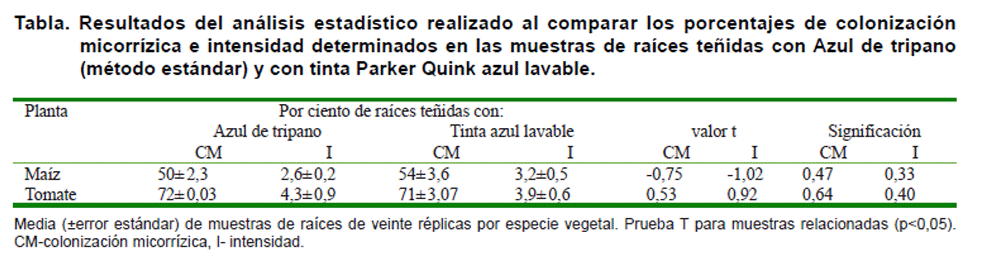
Es importante destacar que no hubo diferencias significativas en el grado de
colonización micorrízica ni en la intensidad determinadas en las
raíces de plantas con diferentes características, evaluadas mediante
los dos métodos de tinción que emplean como colorante el azul
de tripano (método estándar) o la tinta de bolígrafo azul
lavable que propone este trabajo (Tabla).
CONCLUSIONES
Este estudio propone
modificaciones en la técnica de tinción de HMA estándar,
consistentes en la sustitución del colorante azul de tripano por la tinta
de bolígrafo azul Parker Quink lavable en agua, eliminación de
la etapa de incubación de las muestras en solución de ácido
clorhídrico y eliminación del uso de ácido láctico
y glicerina. A la vez que adecua la tinta alternativa a utilizar en la técnica
descrita previamente para este fin. Esto representa un ahorro considerable del
recurso agua, de tiempo y financiero, por el empleo de un menor número
de reactivos. No menos importante es que contribuye a la seguridad y protección
del personal del laboratorio involucrado, pues se evita su exposición
a reactivos cancerígenos y tóxicos, así como a la conservación
del medio ambiente ya que evade la emisión de tales reactivos, ya sea
en forma de gases o en el agua de lavado al mismo.
AGRADECIMIENTOS
A la M.Cs. Emilia
Basulto por su asistencia en la búsqueda de los descriptores correctos.
BIBLIOGRAFÍA
1. Smith, S.;
Read, D. Mycorrhizal Symbiosis. 3ed. London: Academic Press, 2008.
606 pp. ISBN: 9780123705266.
2. Rivera, R.; Fernández, F.; Fernández, K.; Ruiz, L.; Sánchez,
C.; Riera, M. Advances in the Management of Effective Arbuscular Mycorrhizal
Symbiosis in Tropical Ecosystems. En: Hamel, Ch.; Plenchette, Ch. (Eds). Mycorrhizae
in crop production. Haworth Press, Binghampton, New York. 2007. pp. 151-195.
3. Phillips, J. M.; Hayman, D. E. Improved procedures for clearing roots and
staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment
of infection. Trans. Br Mycol. Soc., 1970, vol. 55, pp. 158-161. ISSN:
0007-1536.
4. International Agency for Research on Cancer (IARC). Monogr. Eval. Carcinog.
Risks to Human. [en línea]. [Consultado: 30/Octubre/2013]. Disponible
en: <http://monographs.iarc.fr/ENG/Classification/index.php>.
5. Brundrett, M. C.; Piché, Y.; Peterson, R. L. A new method for observing
the morphology of vesicular-arbuscular mycorrhizae. Can. J. Bot. 1984,
vol. 62, pp. 2128-2134. ISSN: 0008-4026.
6. Kormanik, P. P. y McGraw, A. C. Quantification of vesicular arbuscular mycorrhizae
in plant roots. Methods and principles of mycorrhizal research. The American
Phytopathological Society, St Paul, Minn. 1982. pp. 37-47. ISSN: 0331-949X.
7. Pohanish, R. P. Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens.
6th Ed. Estados Unidos de América, New York: William Andrew Inc. 2011,
3096 pp. ISBN: 978-1-4377-7869-4.
8. Vierheilig, H.; Coughlan, A. P.; Wyss, U.; Piché, Y. Ink and vinegar,
a simple staining technique for arbuscular mycorrhizal fungi. Appl. Environ.
Microbiol. 1998, vol. 64, pp. 5004-5007. ISSN: 1098-5336.
9. Rodríguez, Y.; Dalpé, Y. y Séguin, S. Clasificación
taxonómica de la cepa de hongo micorrizógeno arbuscular INCAM-2
como Funneliformis mosseae, syn. Glomus mosseae. Cultivos
Tropicales, 2014, vol. 35, no. 2, pp. 27-33. ISSN: 0258-5936.
10. Rodríguez, Y.; Dalpé, Y.; Séguin, S.; Fernández,
K.; Fernández, F.; Rivera, R. A. Glomus cubense sp. nov., an
arbuscular mycorrhizal fungus from Cuba. Mycotaxon, 2011, vol. 118,
pp. 337-347. ISSN: 2154-8889.
11. Medina, L. R.; Torres, Y.; Herrera, R.; Rodríguez, Y. Aislamiento
e identificación de hongos micorrízicos arbusculares nativos de
la zona de las Caobas, Holguín. Cultivos Tropicales, 2010, vol.
31, no. 4, pp. 33-42. ISSN: 1819-4087.
12. Redecker, D.; Schüßler, A.; Stockinger, H.; Stürmer, S.;
Morton, J.; Walker, C. An evidence-based consensus for the classification of
arbuscular mycorrhizal fungi (Glomeromycota). Mycorrhiza, 2013, no.
7, pp. 515-31. doi: 10.1007/s00572-013-0486-y.
13. Sieverding, E.; da Silva, G. A.; Berndt, R. y Oehl, F. Rhizoglomus,
a new genus of the Glomeraceae. Mycotaxon, 2014, vol. 129,
no. 2, pp. 373-386. ISSN: 0093-4666.
Recibido: 13 de
mayo de 2014
Aceptado: 13 de diciembre de 2014
Dra.C. JYakelín
Rodríguez Yon, Instituto Nacional de Ciencias Agrícolas (INCA),
gaveta postal 1, San José de las Lajas, Mayabeque, Cuba, CP 32700. Email:
yakelin@inca.edu.cu

