REVISIÓN
BIBLIOGRÁFICA
El aguacatero (Persea americana Mill)
Avocado
(Persea americana Mill)
Dra.C.
Sandra Pérez Álvarez,I Dra.C. Graciela Ávila
Quezada,II Dr.C. Orlando Coto ArbeloIII
IProductora
Agrícola “El Encanto”, Colonia Centro, Guasave, Sinaloa, C.P. 81000.
IIUniversidad Autónoma de Chihuahua, Facultad de
Zootecnia y Ecología, Chihuahua, CP. 31000, México.
IIIInstituto de Investigaciones de Fruticultura
Tropical (IIFT), 7ma e/ 30 y 32, No. 3005, Apartado Postal 11 300, Miramar,
Playa, La Habana, Cuba.
RESUMEN
El aguacatero (Persea
americana Mill) es el único representante de importancia económica
entre las frutas comestibles de la familia Lauraceae y es originario
de México y Centro América. Presenta un creciente valor en el
mercado internacional no solo por su calidad nutritiva sino también por
sus usos medicinales y en la industria cosmética. Este trabajo resume
informaciones relacionadas con las investigaciones sobre esta especie y se discuten
algunos aspectos relevantes sobre sus vías de conservación de
germoplasma, enfermedades así como avances en el mejoramiento genético.
Palabras
clave: aguacatero, conservación, enfermedades, mejoramiento.
ABSTRACT
Avocado (Persea
americana Mill) is the only one commercial important member between edible
fruit which belong to Lauraceae family, it is originated from Mexico
and Central America. It shows a growing value on the international market not
only because its nutritional quality but also due to its medicinal uses and
in cosmetic industry. This work presents information about the research in this
fruit crop and some relevant aspects about germplasm conservation, main diseases
affecting avocados and advances in genetic improvement.
Key words:
avocado, conservation, diseases, breeding.
INTRODUCCIÓN
El aguacatero
(Persea americana Mill) es una especie originaria de México
y Centro América y la única de importancia comercial, desde el
punto de vista económico, de la familia Lauraceae, la cual comprende
alrededor de 2 200 especies. Esta familia abarca plantas leñosas productoras
de esencias que crecen en regiones cálidas y en la que también
se incluyen el laurel (Laurus nobilis L.), el alcanfor (Cinnamomum
camphora (L.) Siebold) y la canela (Cinnamomum verum J. Presl.).
Este delicioso fruto es bien conocido por el hombre desde hace milenios, así
lo muestran las evidencias más antiguas de su consumo provenientes de
una cueva en Coaxcatlán, Puebla, México; con una antigüedad
de 7000 a 8000 años (1), y más allá de su uso comestible
en fresco y procesado tiene amplias aplicaciones como materia prima para la
extracción de aceite y en la industria cosmética (2).
México es el principal productor de este fruto ya que produce una tercera
parte del total mundial y es el principal exportador con el 40 % (1), mientras
Cuba, ocupa el lugar 39 en cuanto a su producción (3).
Los bancos de germoplasma son una de las vías de conservación
de los recursos genéticos vegetales. Una variante de estos bancos basada
en la conservación in vitro es de gran utilidad para la conservación
de cultivos tropicales de importancia agrícola y alimenticia. En los
mismos se busca maximizar la diversidad de ejemplares recolectados de poblaciones
en campo o en su centro de origen (4, 5). En cuanto a los bancos de genes ,en
la actualidad el número de accesiones supera los seis millones (6), por
lo que representan una gran potencialidad para el mejoramiento genético.
Esta especie frutal posee semillas recalcitrantes, que no soportan la deshidratación,
por lo que deben ser almacenadas en ambientes húmedos y conservan su
capacidad germinativa únicamente por corto tiempo, por ello se debe prestar
atención a las vías de conservación de las mismas (7).
Este cultivo es atacado por múltiples enfermedades, entre las que se
encuentran la pudrición de la raíz causada por el oomicete Phytophthora
cinamonni, aunque se ha informado a otras especies de Phytophthora
(Phytophthora heveae Thompson, Phytophthora citrícola
Sawada y Phytophthora palmivora), como agentes causales de esta enfermedad
(8, 9). Otras patologias que afectan a este frutal son: la mancha negra (Cercospora
purporea Cooke) y la antracnosis (Colletotrichum gloeosporioides)
(10).
El mejoramiento genético del aguacatero mediante los métodos de
hibridización convencionales es en extremo difícil, por lo que
han sido limitados los estudios genéticos informados en este sentido
(11, 12). Adicionalmente, el extenso período juvenil y las grandes extensiones
necesarias para el crecimiento de los árboles encarecen los programas
de mejoramiento.
En este trabajo, teniendo en cuenta la importancia del aguacate, se profundizará
en su importancia como frutal, las principales formas de conservación
de sus cultivares, perspectivas y principales enfermedades de esta especie.
Además como problema fundamental, pretende dar una visión actualizada
de su mejoramiento genético y conservación.
Historia del aguacatero
El aguacatero es originario de las regiones tropicales y subtropicales de Centroamérica
y México (13). Los arqueólogos encontraron semillas de Persea
en Perú, las cuales fueron enterradas con momias incas que datan hasta
del año 750 a.C. y hay evidencias de que su cultivo en México
es tan temprano como en el 1 500 a.C. Después de la llegada de los españoles
y de la conquista de América, la especie se diseminó a otros lugares
del mundo (8).
El aguacate posee más de 100 cultivares y clones clasificados en cuatro
razas horticulturales: Guatemalteca (P. americana var Guatemalensis),
Antillana (P. americana var.Drymifolia), Mexicana (P. americana
var Americana) (14) y Costarricense (P. americana var. Costaricensis)
(15). Otros aspectos adicionales relacionados con la diversidad y domesticación
de los aguacateros en América puede ser revisada en otros estudios realizados
(16).
Los ejemplares de P. americana originados en las zonas altas del centro
y este de México generan la raza Mexicana. Los de las zonas altas de
Guatemala generan la raza Guatemalteca, y la raza Antillana proviene de las
primeras plantas encontradas en Las Antillas. Respecto al origen de la raza
Antillana, existen discrepancias pues cabe la posibilidad de que los primeros
ejemplares de esta especie, existentes en Las Antillas, hayan sido introducidos
desde México por lo españoles, o los ingleses durante la colonización
(17). Las variedades más comercializadas internacionalmente son las de
origen Guatemalteca o Mexicana, especialmente ‘Hass’, ‘Fuerte’ y ‘Nabal’ (18).
Características botánicas
Como promedio, el árbol de aguacate puede alcanzar una altura de hasta
20 metros; sin embargo, cuando se cultiva en plantaciones comerciales, no se
deja crecer más de 5 m, para facilitar las prácticas de control
fitosanitario, cosecha, poda y fertilización foliar. Esta especie vegetal
es de tronco grueso y con hojas alargadas, con varias ramificaciones que generan
un follaje denso. Se considera un cultivo perenne debido a que se cultiva durante
todo el año (10).
El fruto es una drupa, en forma de pera, de color verde claro a verde oscuro
y de violeta a negro, cáscara rugosa con una pulpa verde amarillenta
y un hueso central muy grande. Existen aproximadamente unas 400 variedades,
por lo que podemos encontrar frutos de formas y pesos diferentes, que pueden
llegar a pesar de 150 a 350 gr (19).
Algunos de los aspectos de la especie Persea americana Mill relacionados
con la sistemática son los siguientes (8):
Reino: Plantae
División: Magnoliophyta
Clase: Magnoliopsida
Orden: Laurales
Familia: Lauraceae
Género: Persea
Especie: Persea americana Mill
Características genéticas
El número de cromosomas (cariotipo) del aguacatero solo se ha estudiado
en algunas especies: P. americana, P. nubigena, P. borbonia,
P. longipes, P. floccosa, P. palustris, P. cinerascen,
P. schiedeana, P. indica, P. donnell-smithii y P.
pachypoda todos con el número cromosómico de 2n=24, y solamente
se ha identificado una sola especie tetraploide, P. hintonii (20),
originaria de Temascaltepec y Tejupilco, en México. Sin embargo, el mismo
autor identificó algunos tipos de P. americana tetraploides
y triploides provenientes de San Juan de la Vega, en Guanajuato, México.
Es posible que el progenitor salvaje del aguacate cultivado haya sido un árbol
polimórfico que abarcó una amplia zona geográfica desde
el este y el altiplano central de México a través de Guatemala
hasta la costa Pacífica de América Central (21). Pueblos neolíticos
seleccionaron descendientes primitivos domesticados (formas salvajes) desde
estas poblaciones, reemplazando completamente el ancestro salvaje de la especie
P. americana por tres ecotipos bien caracterizados por sus posibles
centros de origen, como las razas horticulturales ya mencionadas. Datos etnobotánicos
(22) y estudios con marcadores genéticos (23) sugieren que estas tres
razas fueron domesticadas de forma independiente y no entraron en contacto hasta
el siglo XVI con los europeos.
A finales de los años 1800 la mejora del aguacatero ganó impulso
vía hibridaciones interraciales entre cultivares de la raza Guatemalteca
y germoplasma mexicano en California y entre germoplasma cubano en Florida (raza
Antillana) y la raza Guatemalteca (24). Un largo periodo de polinización
abierta e hibridaciones interraciales han resultado en cultivares modernos con
mezcla de las tres razas horticulturales que son complejos y con frecuencia
erróneamente caracterizados (23). Su filogenia ha sido difícil
de estudiar, por lo que las relaciones dentro de la familia aún no se
han definido totalmente, y por lo tanto, su taxonomía y nomenclatura
están poco claras (25).
La reciente sugerencia de dos poblaciones genéticas basadas en diferencias
latitudinales en las tierras altas de México deberá estimular
la realización de análisis genéticos futuros en México
y América Central. El aguacatero es uno de los primeros árboles
domesticados en el Neotrópico y puede ser utilizado como modelo de la
domesticación de árboles en áreas con una alta diversidad
biológica (26). La habilidad para desentrañar el origen híbrido
complejo de varios cultivares debe proveer una guía útil para
los que manejan los recursos genéticos (27).
Debido a que, como ya se ha explicado, esta especie presenta un alto grado de
hibridación, la evaluación de las relaciones genéticas
permite distinguir diferentes taxa e identificar material promisorio para programas
de mejoramiento (25).
Importancia económica
La producción y el comercio de aguacate en el mundo se basan, principalmente,
en su utilización como alimento, pues su pulpa es una valiosa fuente
de energía, proteínas y minerales (28).
Este frutal también tiene propiedades medicinales, varios cultivares
poseen cualidades antirraquíticas y un alto poder vermífugo. El
aceite que se extrae se puede utilizar en fricciones para aliviar la gota y
el reumatismo. La infusión de sus hojas se emplea para combatir la fiebre,
los cólicos menstruales y la migraña. Adicionalmente, en la cosmetología
se utiliza para la piel y el cabello con excelentes resultados (29).
Recientemente se ha comprobado que el aguacate es el vegetal que contiene más
carnitina, un ácido aminado que interviene en el metabolismo del músculo
cardíaco, por lo que se está usando en el tratamiento de cardiopatías
y en la falta de apetito (30).
México es el principal productor de aguacate, superando el millón
de toneladas anuales, seguido por Chile y República Dominicana (tabla),
mientras el continente americano concentra el 60 % de las plantaciones mundiales
de este frutal (3).
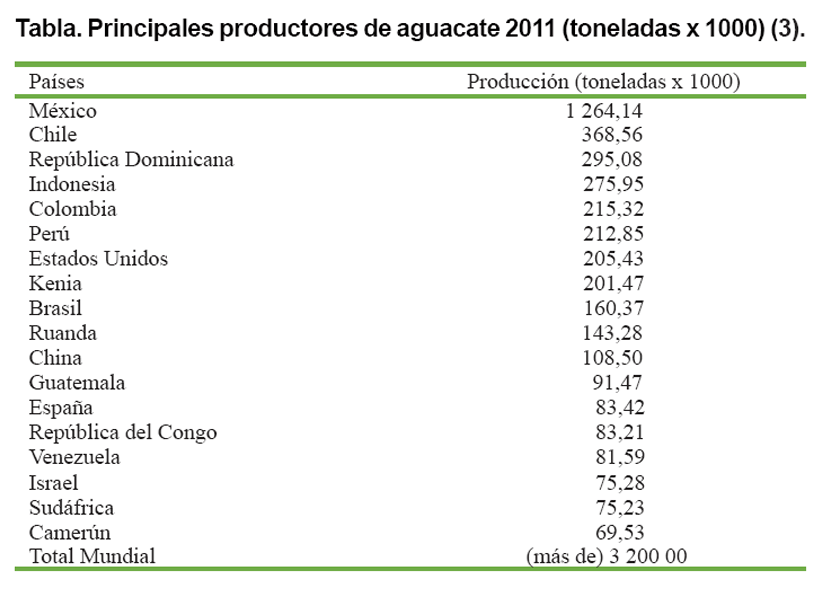
El principal país importador es Francia, con el 39 % del total del volumen
importado, mientras otros importantes compradores son Estados Unidos (10 %),
Reino Unido y Bélgica, estos dos últimos con un 6,5 % cada uno
(3).
Conservación del germoplasma
En la actualidad, la sociedad, entre otras cuestiones, tiene una creciente preocupación
por la conservación de la diversidad biológica, la sustentabilidad
y la equidad en materia agrícola. La diversidad genética en el
acervo vegetal de cada nación, es la herramienta esencial del fitomejorador
por lo que recibe una especial atención, incluyendo el establecimiento
de los bancos de germoplasma para conservar y aprovechar las cualidades agronómicas
de las especies (31). Adicionalmente, los bancos de germoplasma incluyen otras
funciones como la documentación, caracterización, evaluación
de la variabilidad genética, estudios filogenéticos así
como la multiplicación y distribución del germoplasma (32).
La conservación de recursos fitogenéticos de un país debe
estar orientada en función de los recursos disponibles y del plazo por
el cual se desee preservar el germoplasma. Si es por un corto plazo, será
conveniente establecer bancos de semillas; si es por un mediano plazo, se recomienda
la conservación en campo y la conservación in vitro;
y si se desea conservar por un largo periodo, lo más adecuado es emplear
los métodos de crioconservación. Considerando las ventajas e insuficiencias
que presenta cada método, así como las características
botánicas y agronómicas de la especie y género a conservar
se considera que lo óptimo es utilizar varios de estos métodos
que se complementen en el empeño (33).
Debido a la constante pérdida de las especies silvestres de aguacatero
(P. americana) por efecto de la devastación del hombre en los
diferentes sitios de origen en México y Centroamérica, actualmente
la diversidad genética de esta especie se encuentra amenazada (34).
La destrucción del bosque tropical con su taxa Lauraceae, incluyendo
parientes del aguacate, aumenta cada vez más (35). Durante las últimas
tres décadas, los genotipos nativos y semisilvestres de aguacate han
estado desapareciendo rápidamente, al igual que otras especies nativas
(15). En Ecuador, Persea theobromifolia ha sido informada
como casi extinta (Gentry, 1979, citado por 36); conforme esos hábitats
son alterados, un número desconocido de especies está desapareciendo
antes de ser estudiadas y por tanto sin reconocerlas. Por todo lo planteado
las vías de conservación de este cultivo, así como el estudio
y caracterización de plagas y enfermedades tienen una gran relevancia.
Métodos
de conservación genética del aguacatero
• Conservación in situ
La conservación in situ es la conservación de ecosistemas
y hábitats naturales y el mantenimiento y recuperación de poblaciones
viables de diferentes especies. En el caso de especies cultivadas o domesticadas
también abarca la conservación de los alrededores del lugar donde
han desarrollado sus propiedades distintivas. Se considera un proceso de conservación
dinámico, ya que las plantas continúan evolucionando con los cambios
en el ambiente, por lo que resulta muy favorable para los estudios de genética
y evolución (33).
Esta variante de conservación presenta como inconvenientes que el material
vegetal se encuentra vulnerable a desastres naturales y a la devastación
humana, además de que no está fácilmente accesible para
su uso. Asimismo, requiere de regímenes adecuados de manejo y de elevados
niveles de supervisión y monitoreo (37).
La conservación in situ incluye la preservación en áreas
protegidas, así como en fincas y jardines caseros (37). En México
existen zonas protegidas que albergan especies de Persea, entre
ellas la Reserva de la Biosfera Sierra de Manantlán, donde crece
Persea hintonii (38). Sin embargo, se informó que solo
las reservas de Los Tuxtlas y El Triunfo incluyen bosques mesófilos de
montaña que albergan a Persea americana (39). En el siglo pasado
se pensaba que la conservación de los parientes silvestres del aguacatero
era mejor realizarla in situ o como poblaciones naturales en su lugar
de origen (15), pero debido a la acelerada destrucción de esos hábitats
se ha hecho necesario proceder a su rescate para su preservación mediante
la utilización de medios de conservación ex situ.
• Conservación ex situ
Representa la conservación de la diversidad biológica fuera de
su hábitat natural. Implica el muestreo, transferencia y almacenamiento
del material vegetal, desde el área de colecta hasta el lugar donde será
conservado. Se divide en diferentes técnicas, como: el almacenamiento
de semillas, la conservación en el campo, la conservación in
vitro, la crioconservación, el almacenamiento de polen y el almacenamiento
de ADN (37).
El objetivo de la conservación ex situ consiste en mantener
a las colectas sin cambio en su constitución genética (40). Muchas
especies de plantas pueden almacenarse por periodos largos de tiempo a bajas
temperaturas y humedad; sin embargo, hay especies cuyas semillas no se pueden
conservar de esta manera, ya que producen semillas “recalcitrantes”, como es
el caso del género Persea. Este grupo de especies son mantenidas
solamente ex situ como colecciones de campo, in vitro y en
crioconservación, si la especie lo permite.
Existen muchas colecciones ex situ que incluyen accesiones de aguacatero
silvestres y cultivadas, con las mayores colecciones en Estados Unidos (California
y Florida) y en algunos estados de México.
En México, la Universidad Autónoma de Chapingo mantiene una colección
ex situ de unas 180 accesiones de Persea establecidas en dos
localidades a diferentes altitudes (41), mientras otra colección se localiza
en el Instituto Nacional de Investigaciones de Silvicultura y Ganadería
en Guanajuato. En general, se conservan ex situ 500 ejemplares pertenecientes
a 12 especies del género Persea y cuatro especies afines. La
diversidad de esta colección consiste en tipos criollos, silvestres y
selecciones regionales; algunas de ellas se iniciaron en los años 80
y hasta la fecha se conservan accesiones de México, Centro América,
Israel y Chile. Persea americana constituye la especie conservada más
diversa representada por sus cuatro razas botánicas; var. Drymifolia,
var. Guatemalensis, var. Americana y var. Costarricencis (42).
Otras colecciones ex situ que incluyen accesiones de Persea
existen en Guatemala, Honduras, El Salvador, Nicaragua, Costa Rica y Panamá,
que de conjunto con México formaron la Red Mesoamericana de Recursos
Genéticos Vegetales. Otros países mantienen colecciones de interés
como España en la Estación Experimental “La Mayora” en Málaga
(43) y el Centro Volcani en Bet Dagan, Israel (14).
Otros países donde el aguacatero tiene alta demanda han establecido también
colecciones ex situ. En Cuba, la colección del germoplasma de
aguacatero se estableció en 1965 y se nutrió de antiguas colecciones,
incluyendo cultivares suministrados por agricultores, hasta completar 210 genotipos,
a partir de la cual se publicó un catálogo que ofrece la descripción
con 101 descriptores, de 19 cultivares de interés para la producción
(44).
La conservación ex situ en campo resulta costosa y expuesta
a factores climáticos que podrían eliminar los buenos propósitos;
como alternativa más segura se ha propuesto la conservación a
través de métodos alternativos como el método in vitro
a corto-mediano plazo y la criopreservación a largo plazo (45).
• Conservación in vitro
La mayoría de los bancos de germoplasma in vitro especializados
en plantas tropicales se encuentran asociados a centros internacionales de investigación
o conservación y, en menor grado, a universidades. Un ejemplo es el Centro
Agronómico Tropical de Investigación y Enseñanza (CATIE),
en Costa Rica, donde se ha trabajado en el desarrollo de protocolos adecuados
para el almacenamiento in vitro de embriones cigóticos, embriones
somáticos, ápices y semillas de diferentes genotipos de café
(Coffea arabica L.), así como de suspensiones celulares de esta
misma especie y de Musa spp. Esto, además, ha facilitado el
intercambio de recursos fitogenéticos con productores y con organismos
internacionales (46).
El grupo Biodiversidad Internacional (Biodiversity International, BI), anteriormente
conocido como “The International Board for Plant Genetic Resources” (IBPGR),
con sus diferentes sedes en América, Asia, Pacífico, Oceanía,
Europa y África, se ha centrado en la conservación in vitro,
por medio del crecimiento lento, de tallos de cacao (Theobroma cacao
L.), mango (Mangifera indica L.), plátano (Musa sp.),
aguacate
(P. americana) y algunas especies forrajeras (Cynodon spp.
y Digitaria spp.) (46).
Se han realizado numerosos estudios en el aguacatero (P. americana)
para el establecimiento de bancos de germoplasma in vitro. Entre éstos
se trabajó en la conservación in vitro de yemas axilares
de la raza Mexicana y se encontró diferencias significativas entre los
espacios de crecimiento utilizados para la conservación, siendo los tubos
de ensayo (2,0 cm de diámetro x 15 cm de altura) donde la brotación,
número de brotes y longitud de éstos fueron mínimos
(47). En cuanto a la respuesta a la temperatura se señaló
que una temperatura baja (5 °C) resulta adecuada para la óptima conservación
de yemas axilares, ya que ocasiona una inhibición en la brotación.
Así mismo, se demostró que una intensidad de luz de 80 luxes,
logró mantener latentes las yemas, debido a que no hubo prácticamente
brotación ,aunque las yemas sobrevivieron periodo de cultivo in vitro.
En otra investigación, Vargas (48), con yemas axilares de aguacatero
criollo de la raza Mexicana, obtuvo crecimiento de las plantas en un medio Murashige
y Skoog (MS) (49) que contenía brasinoesteroides (BA), logrando sobrevivir
después de ser tratadas a bajas temperaturas. La concentración
de 4 mg L-1 fue la que mostró un mayor efecto sobre la sobrevivencia
y la concentración de 8 mg L-1 influyó más en
el crecimiento; en comparación con los brotes que fueron crecidos en
el medio que contenía solamente BA (testigo), los cuales no lograron
sobrevivir. Adicionalmente, las pruebas de microscopía electrónica
demostraron un claro efecto en la preservación, la fisiología
y la integración de los brotes crecidos y mantenidos en Brasinolide (48).
• Crioconservación
o criopreservación
La criopreservación es una técnica a largo plazo que se basa en
la reducción y paro subsecuente de todas las funciones metabólicas
de los explantes, incluyendo la división celular por efecto del nitrógeno
líquido (-196 oC); este es un método de conservación
a largo plazo, rentable y seguro para especies que tienen semillas recalcitrantes
o se propagan vegetativamente, como es el caso del aguacatero (P. americana)
(50).
Sin embargo, para lograr un protocolo eficiente de crioconservación se
requiere, en principio definir las técnicas más adecuadas, como
es la deshidratación del tejido y el uso de sustancias crioprotectoras
(51).
En estudios con yemas axilares de cultivares Guatemaltecos y Mexicanos (52),
se evaluó el tiempo de deshidratación con aire estéril,
soluciones crioprotectoras y el procedimiento de congelación y se determinó
que el parámetro más importante a medir fue el promedio de supervivencia;
adicionalmente se realizaron pruebas de viabilidad química de las células
por observación directa en microscopio de epifluorescencia, previa tinción
con diacetato de fluoresceína (prueba FDA). Aunque no se logró
tener éxito en la regeneración de brotes, sí se obtuvo
información de la prueba de viabilidad, los explantes con menor tiempo
de deshidratación mostraron un porcentaje de viabilidad bajo, por lo
que es conveniente disminuir el contenido de agua del material vegetal para
reducir los efectos de la formación de hielo en la congelación.
Los resultados indicaron que el mejor tiempo de deshidratado fue 120 minutos,
a partir de que los porcentajes de viabilidad (fluorescencia) fueron los más
uniformes.
En otro estudio se evaluaron seis tiempos de deshidratado de yemas axilares
de aguacate criollo raza Mexicana producidas in vitro (51), con aire
estéril en campana de flujo laminar durante 30, 60, 90, 120, 150 y 180
minutos y dos soluciones crioprotectoras PVS2 (30 % de glicerol+15 % de etilenglicol+15
% DMSO+medio con 0,4 M de sacarosa) y PVS4 (35 % de glicerol+ 20 % de etilenglicol
+ medio con 0,6 M de sacarosa). Los resultados indicaron que con 60 minutos
de deshidratación y manteniendo las yemas en una solución PVS4
durante 30 minutos a 0 oC se obtienen plantas con desarrollo normal,
con brotes, hojas bien formadas de color verde oscuro y 100 % de sobrevivencia
a los 30, 45 y 60 días después de establecer las yemas en medio
de brotación.
Mejoramiento genético
Los mejoradores de aguacate tienen que enfrentar numerosos retos, por ejemplo,
la gran dificultad de disponer de cruces controlados, un largo estado de inmadurez
que limita el avance del mejoramiento, las grandes extensiones de tierra necesarias
para los experimentos; de hecho, el gran número de labores en el cultivo
hacen que este sea un proceso caro. Desde el punto de vista biológico,
de los millones de flores producidas solo una pequeña fracción
da lugar a frutos que logran alcanzar la madurez y de éstos, una parte
tiende a abortar y caer; por otro lado, la polinización manual no es
fiable, mientras que el control de la polinización utilizando jaulas,
ha tenido un éxito limitado. Desde el punto de vista genético,
como ya se mencionó, el aguacatero es altamente heterocigótico,
por ello el comportamiento de las progenies resulta impredecible y las posturas
producidas por un solo árbol son extremadamente variables. Entre las
pocas ventajas que presenta este cultivo está la habilidad de propagar
a los genotipos deseables mediante injerto (53).
La polinización abierta y la hibridación seguida de la selección
de materiales promisorios en la progenie ha sido el único método
disponible para los mejoradores de aguacate (54). La necesidad de disponer de
un rango más amplio de cultivares élites impulsó a los
programas de mejoramiento genético a evaluar miles de posturas en la
búsqueda, tanto de patrones tolerantes a la pudrición de la raíz
causada por Phytophthora, como a la salinidad del suelo y a suelos
calcáreos (55).
Adicionalmente, el comportamiento industrial del aguacatero se ha basado en
pocos cultivares, lo que ha sugerido que solo una parte de los recursos genéticos
del género Persea se han desarrollado, por lo que resulta muy
importante proteger y desarrollar el germoplasma silvestre de este cultivo.
El desarrollo de nuevos cultivares y patrones deben contribuir a este propósito.
En este sentido, los mejoradores se han interesado en seleccionar cultivares
con rendimientos altos y estables, pero también con resistencia a estreses
bióticos y abióticos (53).
Marcadores moleculares, diversidad, mapeo genético y selección
asistida en aguacatero
Las tecnologías de marcadores moleculares pueden asistir como herramientas
útiles a los programas de mejoramiento convencionales para el análisis
de las relaciones genéticas, la identificación y selección
de genotipos de interés, así como la conservación del germoplasma.
En aguacatero los primeros marcadores moleculares utilizados fueron las isoenzimas
para conocer aspectos relacionados con su perennidad y sistemas de cultivo,
así como con la identificación de variedades. En Cuba se utilizaron
a inicios de este siglo en un estudio de diversidad en cultivares de origen
antillano y guatemalteco, así como sus híbridos (56).
Debido a la importancia de la hibridación en el aguacate y a su evolución
reticulada, las relaciones genéticas deben ser estudiadas con métodos
que capten la diversidad genética y que incluyan los de inferencia histórica.
El desarrollo de los marcadores basados en el ADN ha tenido impacto en las investigaciones
con aguacatero. Los marcadores basados en el polimorfismo de la longitud de
los fragmentos de restricción (Restriction Fragment Lenght Polymorphism,
RFLP) se utilizaron en estudios evolutivos, filogenéticos (57) y genealógicos
(58). Otros tipos de marcadores como los minisatélites fueron utilizados
para estudios similares y con los mismos resultados en relación con la
identificación de las tres razas horticulturales ya descritas (59), lo
que también fue corroborado mediante marcadores basados en el ADN polimórfico
amplificado al azar (Random Amplified Polymorphic DNA, RAPD) y microsatélites
(54).
Otros marcadores utilizados con éxito han sido los microsatélites
(SSR). Algunos autores (60) estimaron en 45 000 el número de éstos
presentes en el genoma de este cultivo y marcadores de este tipo se desarrollaron
para estudios de relaciones genéticas entre cultivares (61). Asimismo,
marcadores como los basados en el polimorfismo de la longitud de los fragmentos
amplificados (Amplified Fragment Lenght Polymorphism, AFLP) también son
útiles, debido a su alto poder discriminatorio y a pesar de sus bajos
niveles de heterocigosidad. Se utilizaron con éxito 12 combinaciones
de cebadores de AFLP y 16 de los SSR desarrollados para aguacatero para determinar
estimados de distancia genética e identificar inequívocamente
23 cultivares de interés comercial en Cuba (62), mientras que, al utilizar
AFLPs se indicó la necesidad de usar marcadores más específicos
como SSRs para diferenciar cultivares de aguacate de raza mexicana (63).
En este sentido se emplearon marcadores ISSRs o inter secuencias simples repetidas
(Inter Simple Sequence Repeats) en 77 colectas (231 individuos) de Persea
americana Mill. raza Mexicana, existentes en el banco de germoplasma del
INIFAP-CFAP_Uruapan, Michoacán (64) y se encontraron entre 82,28-95,39
% de polimorfismo que permitió formar dos grandes grupos de diversidad,
sin materiales duplicados, por lo que se sugiere mantener intacta esta colección
con fines de mejoramiento genético.
Para profundizar en la relación genética de las tres primeras
razas identificadas Gross-German y Viruel (65) se emplearon 25 microsatélites
y 15 cebadores correspondientes a secuencias marcadas expresadas de SSRs (Expressed
Sequences Tag, ESTs-SSRs) en un grupo de 42 accesiones y se confirmó
la existencia de tres grupos o subpoblaciones sobre la base de las razas botánicas:
Mexicana, híbridos Guatemalteca-Mexicana y Antillana (65), mientras las
subpoblaciones Guatemaltecas x Mexicanas fueron las únicas que mostraron
más individuos heterocigóticos que los esperados por el equilibrio
Hardy–Weinberg (F=-0,114), apuntando a su naturaleza híbrida. Finalmente,
los resultados indicaron que las razas Mexicana y Guatemalteca están
más cercanas entre sí que la Antillana.
Se desarrollaron 25 marcadores microsatélites para diferenciar 35 cultivares
de aguacate y dos especies silvestres relacionadas (23). El promedio de heterocigosis
fue alto (60,7 %) y llegaron a la conclusión de la existencia de la antigua
hibridación o que las razas botánicas se originaron más
recientemente de lo que se pensaba anteriormente. Siguiendo esta misma línea
de investigación se caracterizaron 75 accesiones de aguacate utilizando
16 microsatélites previamente desarrollados en estas especies (43), obteniendo
156 fragmentos amplificados diferentes con un promedio de 9,75 alelos por locus
y desarrollaron un dendograma donde los genotipos analizados clasificaron dentro
de tres grandes grupos, encontrándose las mayores diferencias en el origen
de las razas.
También los retrotransposones se han utilizado con éxito en las
investigaciones en aguacatero. En un estudio más detallado de una colección
de 17 cultivares de aguacatero de la colección de Cuba, utilizando el
polimorfismo basado en secuencias repetidas marcadas e inversas (Inverse Sequences
Tagged Repeats, ISTR), se compararon los niveles de polimorfismo, capacidad
de discriminación e informatividad de caracteres morfoagronómicos
y de los marcadores AFLP, ISTR, SSR e isoenzimas (66). Los resultados mostraron
que el poder de discriminación (D) utilizado para caracteres
morfoagronómicos, fue útil para la identificación de genotipos.
Sólo cuatro variables fueron necesarias para distinguirlos: forma del
fruto, época de cosecha, color y espesor de la corteza del fruto. De
esta forma los marcadores utilizados constituyeron técnicas poderosas
para la discriminación y certificación varietal, pero los marcadores
dominantes resultaron los más eficientes. Se demostró además,
que con una simple combinación de cebadores AFLP o ISTR se identificaron
todos los individuos. Por otra parte, los niveles más elevados de heterocigosidad
esperada se detectaron con marcadores codominantes, pero el valor determinado
con los microsatélites superó en dos veces o más los obtenidos
con isoenzimas y marcadores dominantes. El índice de diversidad morfológica
resultó un buen estimador de la diversidad de las accesiones de aguacatero
cuando se utilizaron variables de gran heredabilidad, y a su vez, comparable
con la heterocigosidad esperada determinada con las isoenzimas y los marcadores
basados en el ADN.
El valor de este índice fue similar a los obtenidos con ISTR y AFLP.
Los índices de eficiencia del ensayo (Ai) y del marcador (MI)
tuvieron el mismo patrón de variación que D, el número
promedio de patrones de bandas o estados por unidad de ensayo (I),
el número promedio de patrones de bandas únicas por unidad de
ensayo (Iu) y el número efectivo de patrones por unidad de ensayo
(P) para todos los marcadores moleculares, lo que sugiere que ambos
índices probablemente son indicadores de la capacidad de discriminación
en el aguacatero.
La secuenciación del transcriptoma de este cultivo, el mapeo genómico
y la secuenciación parcial del genoma representan un gran paso dirigido
al objetivo que es secuenciar el genoma completo, con lo cual se espera ayudar
en la mejora de los cultivares y la producción. Además, la continuidad
de estudios comparativos y de evolución en flores y frutos de aguacate
en diferentes cultivares, puede fortalecerse con la expresión de genes,
incluyendo comparaciones con parientes del aguacate. Esto deberá proveer
informaciones importantes relacionadas con la regulación genética
del desarrollo del fruto en angiospermas (67). Este gran avance de investigaciones
en aguacatero acaba de ser informado por investigadores que completaron la secuenciación
del genoma del aguacatero (68); en este sentido los estimados sugieren que el
genoma de aguacatero contiene cerca de 34 000 genes, 29 345 de ellos con evidencia
de actividad transcripcional. Este resultado, unido a la demostrada amplia diversidad
genética de este cultivo, puede utilizarse para la identificación
de genes involucrados en caracteres relacionados con la calidad de los frutos
y el tamaño de las plantas, entre otros, mediante el enfoque basado en
mapeo por asociación.
Mejoramiento
por inducción de mutaciones, selección in vitro y estrés
abiótico
Las técnicas de inducción de mutaciones son métodos alternativos
del mejoramiento que han sido utilizadas ampliamente en los principales cultivos
de interés económico, los ornamentales y, eventualmente, en los
cultivos frutícolas perennes (69); sin embargo, los intentos de su uso
en aguacatero han sido escasos y se limitaron a modificar la arquitectura de
la planta, a influir en el desarrollo vegetativo, la floración, el cuajado
de los frutos y en inducir ciertos cambios en la fructificación (70).
El mejoramiento genético del aguacatero en Cuba dispone hoy de las curvas
de radiosensibilidad de dos cultivares utilizados como portainjertos, ‘Duke-7’
y ‘Hass’; los valores de dosis letales medias, definidas como las dosis, a las
cuales se obtiene el 50 % de los brotes completos se estimó en 28 y 27
grays (Gy) para los dos cultivares anteriores respectivamente. Aunque los resultados
mostrados por algunos autores (71) sugirieron una sensibilidad similar a las
radiaciones Gamma en ambos genotipos, se demostró que ‘Hass’ se comporta
como más sensible a altas dosis de radiación. Estos resultados
tienen utilidad inmediata en la generación de posibles poblaciones de
mutantes que pueden resultar de utilidad en el mejoramiento por inducción
de mutaciones de cultivares de aguacatero.
En cuanto al estrés abiótico se puede afirmar que la salinidad
afecta casi todos los aspectos fisiológicos y bioquímicos de las
plantas y reduce significativamente los rendimientos. El estrés por salinidad
es uno de los estrés ambientales que induce cambios en el crecimiento
y la morfología de las plantas y se conoce que el aguacatero es el árbol
frutal más sensible a este estrés (72), sensibilidad que ha limitado
su producción intensiva.
Se han observado diferentes niveles de tolerancia a la sal entre las tres principales
razas horticulturales de aguacatero, donde los miembros de la raza mexicana
son los más sensibles, los patrones guatemaltecos muestran una tolerancia
intermedia y los antillanos son los más resistentes, mientras varios
estudios han incursionado en evaluar los cambios en las concentraciones de iones
como el magnesio, calcio, potasio, sodio y cloro (73).
En este sentido, la combinación de métodos in vitro y
de inducción de mutaciones puede aportar valiosos resultados. Adicionalmente,
estos protocolos son relativamente fáciles de usar, baratos y se convierten
en métodos de gran aplicabilidad.
Enfermedades que más afectan al aguacatero
La producción de aguacate a nivel mundial es afectada por varias enfermedades
las cuales pueden limitar económicamente la producción y reducir
la calidad de los frutos (74). Entre las más comunes se encuentra el
‘sunblotch viroid’, que afecta frutos y hojas, muchas veces los árboles
enfermos no muestran síntomas pero producen semillas que al utilizarse
como patrones transmiten la enfermedad.
La antracnosis causada por Colletotrichum gloeosporioides afecta tallos,
hojas, flores y frutos, es la enfermedad que más afecta durante la poscosecha
(75,76); sin embargo, también se identificó a C. acutatum
como agente causal de antracnosis en frutos, el cual fue aislado e identificado
mediante morfología y análisis filogenético con el gen
ITS (75). Otra enfermedad poscosecha es causada por Lasiodiplodia theobromae
e identificado por morfología y secuenciación del gen ITS (77).
Otras especies de hongos también provocan afectaciones, por ejemplo,
especies de Botryosphaeria (Botryosphaeria parva, Botryosphaeria
dothidea y Dothiorella aromatica (= F. luteum) asi como
otras especies, incluso informadas por primera vez, que causan cáncer
de ramas y marchitez en arboles de aguacate en California (78).
Algunos autores informan a Neofusicoccum luteum como un patógeno
más agresivo que Colletotrichum gloeosporioides o Phomopsis
sp. pero con la misma patogenicidad que N. parvum para causar marchitez
de puntas en aguacate (78); se informó además a N. parvum
causando el mismo daño en arboles en España (79) y México
(80); mientras se informa a Neofusicoccum australe (Botryosphaeria
australis) provocando la misma enfermedad en Chile (81).
La marchitez del laurel se ha observado afectando árboles de aguacatero
(82), es causada por el nuevo patógeno vascular conocido como Raffaelea
lauricola. Esta enfermedad estaba documentada en Lauraceae en
la costa de Carolina del Sur, Georgia, y noroeste de Florida, desde el 2003
(83).
Entre otras enfermedades informadas están la marchitez por Verticillium,
causada por el hongo del suelo Verticillium dahliae que afecta
las hojas, también las enfermedades causadas por especies de Erwinia
asociadas con la antracnosis y que afectan los frutos (84).
Entre las enfermedades bacterianas se informó de afectaciones por Xylella
fastidiosa, causando moteado clorótico, quemadura marginal, deformación
de hojas, defoliación, acortamiento de los entrenudos y marchitez de
ramas (85). También se ha identificado a Xanthomonas axonopodis causando
manchas pequeñas, negras y angulares en las hojas y se considera la enfermedad
bacteriana más importante en hojas de aguacate (86).
Asimismo, se han detectado afectaciones por fitoplasma como el Stolbur causando
enrollamiento foliar, clorosis venial foliar, seguido de un color rojizo anormal
y un enanismo irregular (86). Mientras entre los viroides se identificó
el viroide de la mancha de sol (Avocado Sunblotch Viroid, ASBVd) provocando
en el fruto vetas amarillas y profundas,que se tornan necróticas o rojizas
(87).
Sin embargo, la enfermedad que más daño provoca en el aguacatero
es la pudrición causada por especies de Phytophthora. Varias
especies de Phytophthora causan el cancro del tronco y las ramas P.
cinnamomi Rands ha sido descrita como causa ocasional de cancros en Australia,
Brasil, California, Camerún y Sudáfrica. P. heveae Thompson,
causante de la raya negra del caucho en Malasia, fue encontrada como la causa
del cancro y del tronco sangrante en los árboles de aguacate de Guatemala
(88) y P. citricola Sawada, cuyo daño se incrementa en las plantaciones
de aguacate en California (89). También se ha detectado Phytophthora
palmivora Butler (Butler) (8, 9) y Phytophthora nicotianae (90)
causando pudrición de la raíz en aguacatero.
La identificación de los agentes causales de enfermedades cobra especial
importancia en la actualidad, el cambio climático puede afectar la interacción
de las comunidades de patógenos como las relaciones de mutualismo, competencia,
predadores y la cadena alimenticia, mientras algunas especies se pueden adaptar
más rápido que otras al cambio climático y modificar sus
hábitos (90). Por ello, el empleo de herramientas basadas en marcadores
moleculares permite realizar la identificación certera de muchas de las
espécies de patógenos mencionadas anteriormente, esto permite
trazar estrategias adecuadas para el manejo y control de las enfermedades que
afectan al aguacatero.
CONCLUSIONES
La combinación
de la inducción de mutaciones y la selección en poblaciones de
polinización abierta como vía de generar variabilidad, de conjunto
con la aplicación de otros avances biotecnológicos como la selección
in vitro y la aplicación de enfoques genómicos y proteómicos,
a partir de la generación de la secuencia completa del genoma de este
cultivo, sienta las bases para la implementación del mejoramiento asistido
por marcadores en aguacatero.
El desarrollo alcanzado por los marcadores moleculares en la identificación
rápida y certera de los patógenos que afectan este cultivo permite
trazar estrategias eficientes para el manejo y control de las enfermedades por
ellos causadas en aguacatero.
AGRADECIMIENTOS
La Academia de
Ciencias del Tercer Mundo (TWAS) apoyó la consolidación de este
trabajo financiando una estancia posdoctoral en el Centro de Alimentación
y Desarrollo (CIAD) de Delicias, estado de Chihuahua, México.
BIBLIOGRAFÍA
1. Agenda de innovación
Guerrero. Aguacate. Fundación produce de Guerrero. [en línea].
2012. pp. 169-186. Disponible en: <http://fundacionproducegro.org.mx/wp-content/uploads/2013/09/Agenda+2012-2015.pdf>.
2. Fajardo, L. R.; Freire, M. S.; García, Y. R. y Argentel, L. M. Formación
de embriones somáticos en Persea americana Mill var. Catalina
a partir de embriones cigóticos inmaduros. Biotecnología Vegetal,
2005, vol. 5, no. 2, pp. 103-107. ISSN: 2074-8647.
3. FAOSTAT. [en línea]. [Consultdo: 25/06/2013]. Disponible en: <http://faostat.fao.org/site/340/default.aspx>.
4. Wang, Y. L.; Fan, M. J. y Liaw, S. L. Cryopreservation of in vitro–grown
shoot tips of papaya (Carica papaya L.) by vitrification. Botanical
Bulletin of the Academia Sinica, 2005, vol. 46, pp. 29-34. ISSN: 0006-8063.
5. Tyagi, R. K.; Agrawal, A.; Mahalakshmi, C.; Hussain, Z. y Tyagi, H. Low-cost
media for in vitro conservation of turmeric (Curcuma longa
L.) and genetic stability assessment using RAPD markers. In Vitro Cellular
and Developmental Biology Plant, 2007, vol. 43, pp. 51-58. ISSN: 1054-5476.
6. Borokini, T. I. The state of ex-situ conservation in Nigeria. International
Journal of Conservation Science, 2013, vol. 4, no. 2, pp. 197-212. ISSN:
2067-8223.
7. Sánchez-Chiang, N. y Jiménez, V. M. Técnicas de conservación
in vitro para el establecimiento de bancos de germoplasma en cultivos
tropicales. Revisión Bibliográfica. Agronomía Mesoamericana,
2010, vol. 21, no. 1, pp. 193-205. ISSN: 1659-1321.
8. Teliz-Ortíz, D.; Mora-Aguilera, G. y Morales-García, L. Importancia
histórica y socioeconómica del aguacate. En: El aguacate y su
manejo integrado. Téliz-Ortíz, D. (coord.). Mundi Prensa. México,
2000.
9. Machado, M. C.; Collazo, M.; Renaud, M. A; López, M. O.; Coto, O.;
Zamora, V. y Cabrera, R. I.; Boland. G. J. First report of Phytophthora
palmivora Butler causing root rot on avocado (Persea americana
Mill.) in Cuba. Canadian Journal of Plant Pathology, 2012, vol. 34,
no. 2, pp. 323-348. ISSN: 1918-1833.
10. Monografía de cultivos. Aguacate. Subsecretaria de Fomento de Agronegocios,
2011, pp. 1-10.
11. Lavi, U.; Lahav, E.; Degani, C.; Gazit, S. y Hillel, J. Genetic variance
components and heritatabilities of several avocado traits. J. Amer. Soc.
Hort. Sci., 1993, vol. 118, pp. 400-404. ISSN: 2327-9788.
12. Pliego-Alfaro, F. y Bergh, B. O. Avocado. En: Biotechnology of Perennial
Fruit Crops. Hammerschlag, F. A. and Litz, R. E. (eds), C.A.B., International,
Wallingford, UK, 1992, pp. 323-333.
13. Garbanzo, M. S. Manual de aguacate. Buenas prácticas de cultivo variedad
Hass. Ministerio de agricultura y ganadería. 2 ed. San José, C.
R. 2010, 19 pp.
14. Lavi, U.; Sa’ada, D.; Ragev, I. y Lahav, E. Avocado genetics and breeding-present
and future. World Avocado Congr VA, 2003, vol. 42, pp.134-135.
15. Ben-Ya’acov, A.; Solis-Molin, A. y Bufler, G. The mountain avocado of Costa
Rica Persea americana var. costarricense, a new sub-species. En: Proceeding
of the 5th world avocado congress. Granada, 2003. pp. 19-24. Spain, pp. 27-33.
16. Galindo-Tovar, M. E.; Ogata- Aguilar, N. y Arzate-Fernández, A. M.
Some aspects of avocado (Persea americana Mill.) diversity and domestication
in Mesoamerica. Genet Resour Crop Evol, 2008, vol. 55, pp. 441-450.
ISSN: 1573-5109.
17. Méndez, C. H. y Rodríguez, L. H. Manejo de plantaciones nuevas
de aguacate. Información Técnica. Agro Cabildo, 2011, pp. 1-11.
18. Díaz, S. D. A. y Arango, C. B. Manual Técnico del Cultivo
del Aguacate. Bogotá, Colombia: Aproare SAT - Instituto Colombiano Agropecuario
ICA, 2010.
19. Rodríguez,
A. N. y Sánchez, P. P. Especies de frutales cultivadas en Cuba en la
Agricultura Urbana. 3ra Edición, La Habana 2005.
20. García, A. Cytogenetical studies in the genus Persea (Lauraceae).
I. Karyology of seven species. Can. J. Genet. Cytol, 1975, vol. 17,
pp. 173-180. ISSN: 0008-4093.
21. Smith, C. E. Archaeological evidence for selection in avocado. Econ
Bot. 1966, vol. 20, pp. 169-175. ISSN: 0013-0001.
22. Storey, W. B.; Bergh, B. O. y Zentmyer, G. A. The origin, indigenous range
and dissemination of the avocado. Calif Avocado Soc Yearb, 1986, vol.
70, pp. 127-133. ISSN: 0886-7690.
23. Ashworth, V. E. T. M. y Clegg, M. T. Microsatellite markers in avocado (Persea
americana Mill.). Genealogical relationships among cultivated avocado genotypes.
Journal of Heredity, 2003, vol. 94, pp. 404-415. ISSN: 0022-1503.
24. Davenport, T. L. Avocado flowering. Hortic Rev. 1986, vol. 8, pp.
257-289. ISSN: 1027-152X.
25. Galindo-Tovar, M. E.; Milagro-Pérez, P. A.; Alejandre-Rosas, J. A.;
Leyva-Ovalle, O. R.; Landero-Torres, I.; Lee-Espinosa, H.; y Murguía-González,
J. Relaciones genéticas del aguacate (Persea americana Mill.)
en siete municipios del centro de Veracruz, caracterizadas con microsatélites.
Tropical and Subtropical Agroecosystems, 2011, vol. 13, pp. 339-346.
ISSN: 1870-0462.
26. Galindo-Tovar, M. E.; Ogata-Aguilar, N.; Arzate-Fernandez, A. M. Some aspects
of avocado (Persea americana Mill.) diversity and domestication in
Mesoamerica. Genet Resour Crop Evol. 2007, doi: 10.1007/s10722-007-9250-5.
27. Chen, H.; Morrell, P. L.; Ashworth, V. E.; De La Cruz, M. y Clegg, M. T.
Tracing the Geographic Origins of Major Avocado Cultivars. Journal of Heredity,
2009, vol. 100, no. 1, pp. 56-65. ISSN: 0022-1503.
28. Belén, M. P. El aguacate y sus diferentes aplicaciones en 25 recetas.
Universidad de Cuencas, Ecuador, 2010, pp. 19-26.
29. Santillán, M. E.; Meza, M. G.; Navarro, R. I.; Gómez, H. P.
y Rodríguez, E. S. Fabricación de productos cosméticos
y de consumo humano a base de bagazo de aguacate (Persea americana).
Avances en la investigación científica en el CUCBA. XIX Jornada
Nacional de la Investigación Científica, 2008. ISBN: 978-607-00-2083-4.
30. Viikari, J.; Niinikoski, H.; Raitakari, O. y Simell, O. The initiatives
and outcomes forcardiovascular risks that can be achieved through pediatric
counselling. Curr Opin in Lipidol, 2009, vol. 20, no. 1, pp. 17-23.
ISSN: 1473-6535.
31. López-López, L.; Barrientos-Priego, A. F. y Ben-Ya’acov, A.
D. Variabilidad genética de los bancos de germoplasma de aguacate preservados
en el estado de méxico. Revista Chapingo Serie Horticultura,
1999, vol. 5, pp. 19-23. ISSN: 2007-4034.
32. Graur, D. y Wen-Hsiung, R. I. Fundamentals of Molecular Evolution. Sinauer
Associates Inc. USA, 2000, 481 pp.
33. Castilla, Y. V. Conservación de recursos fitogenéticos de
cafeto (Coffea spp.) por métodos biotecnológicos: una
alternativa para su preservación. Cultivos Tropicales, 2012, vol.
33, no. 4, pp. 29-39. ISSN: 1819-4087.
34. Barrientos-Priego, A.; Reyes-Alemán, J. C. y Aguilar-Melchor, J.
J. Manual Gráfico para la Descripción Varietal de Aguacate. Red
Aguacate, Sinarefi, Snics-Sagarpa, 2010, 176 pp.
35. Acosta, S. C. Plantas vasculares raras, amenazadas, o en peligro de extinción
del estado de Oaxaca, un panorama preliminar. Polibotánica,
2002, no. 13, pp. 47-82. ISSN: 1405-2768.
36. Barrientos Priego, A. F.; Borys, M. W.; Escamilla-Prado, E.; Ben-Ya’acov,
A. D.; De La Cruz-Torres, E. y López-López, L. Study of the avocado
germplasm resources, 1988-1990. IV. Findings in the Mexican Gulf region. Proc.
of Second World Avocado Congress, 1992, pp. 551-558.
37. Engelmann, F. y Dulloo, E. M. Introduction. En: Engelmann, F.; Dulloo, M.
E.; Astorga, C.; Dussert, S. y Anthony, F. Conserving coffee genetic resources.
Roma: Biodiversity International, 2007, pp. 1-11.
38. Figueroa-Rangel, B. L. y Olvera-Vargas, M. Regeneration patterns in relation
to canopy species composition and site variables in mixed oak forests in the
Sierra de Manatlán Biosphere Reserve, Mexico. Ecological Research,
2000, vol. 15, pp. 249-261. ISSN: 0912-3814.
39. Lorea-Hernández, F. G. La familia Lauraceae en el sur de
México: diversidad, distribución y estado de conservación.
Boletín de la Sociedad Botánica de México, 2002,
vol. 71, pp. 59-70.
40. Karp, A.; Kresovich, S.; Bhat, K. V.; Ayad, W. G. y Hodgkin, T. Molecular
Tools in Plant Genetic Resources Conservation: a Guide to the Technologies.
IPGRI Technical Bulletin No. 2. 47 pp. Molecular Ecology Notes 1, 1997, pp.
205-208.
41. Aguilar-Gallegos, N.; Barrientos-Priego, A.; Núñez-Colin,
C. y Nieto-Ángel, R. Distribution and potential areas for collecting
of Persea americana Mill. Germplasm in Mexico. En: Proceeding of 6th
world avocado congress: 2007, 12-16 November: Viña del Mar. Sect Varieties
(Abstract).
42. Reyes, J. C. A.; de la Cruz, M. E. B.; Barrientos, A. P.; Aguilar, J. J.
M. y Bernal, B. V. Conservación ex situ de Ejemplares del Género
Persea Correspondientes a 12 Especies y 4 Genotipos Afines. Proceedings
VII World Avocado Congress 2011 (Actas VII Congreso Mundial del Aguacate 2011).
Cairns, Australia, pp. 5-9.
43 Alcaraz, M. L. y Hormaza, J. I. Molecular characterization and genetic diversity
in an avocado collection of cultivars and local Spanish genotypes using SSR.
Hereditas, 2008, vol. 144, pp. 244-253. ISSN: 0018-0661.
44. Rodríguez, N. N.; Fuentes, V. R.; Velásquez, J. B.; González,
G. L.; Sourd, D. G.; Rodríguez, J. A. y Ramirez. I. M. Catálogo
de cultivares de aguacatero en Cuba. Instituto de Investigaciones en Fruticultura
Tropical (IIFT), 2010, ISBN: 978959296022-0.
45. Vidales-Fernández, I.; Larios-Guzmán, A.; Tapia Vargas, L.
M.; Guillén-Andrade, H. y Villaseñor-Ramírez, F. Criopreservación
de germoplasma de aguacate. VII World Avocado Congress 2011 (Actas VII Congreso
Mundial del Aguacate 2011). Cairns, Australia, pp. 5-9.
46. García-Águila, L.; de Feria, M. y Acosta, K. Aspectos básicos
de la conservación in vitro de germoplasma vegetal. Biotecnología
Vegetal, 2007, vol. 7, no. 2, pp. 67-79. ISSN: 2074-8647.
47. Ángel, P. M. E. Influencia de medios mínimos, inhibidores
del crecimiento y temperatura en la conservación in vitro del
germoplasma de aguacate (Persea americana Mill. var. drymifolia).
Universidad de Colima. Tesis de Doctorado en Ciencias del área ciencias
agrícolas y forestales. 2003, 123 pp.
48. Vargas, V. M. Efecto fisiológico de brasinoesteroides y crioprotectores
sobre yemas axilares de aguacate criollo producidas in vitro. Tesis
de Doctor en Ciencias. Universidad Autónoma de Nayarit. 2008, 157 pp.
49. Murashige, T. y Skoog, F. A revised medium for rapid growth and bioassays
with tobacco tissue cultures. Physiol. Plant, 1962, vol. 15, pp. 473-497.
50. Panis, B. Crioconservación de germoplasma de Musa. 2a edición.
Guías técnicas No. 9. Bioversity International, Montpellier, Francia.
2009.
51. Vidales-Fernández, I.; Rodríguez-Jiménez, J.; Salgado-Garciglia,
R.; López-Gómez, R. y Angel-Palomares, E.; Guillén-Andrade,
H. Deshidratación y soluciones crioprotectoras de aguacate criollo (Persea
americana Mill. var. drymifolia) producidas in vitro. Resumen
en la memoria del VI Congreso Mundial de la Palta, celebrado en Viña
del Mar, 2007. Chile. 59 pp.
52. Vargas, V. M. Efecto fisiológico de brasinoesteroides y crioprotectores
sobre yemas axilares de aguacate criollo producidas in vitro. Avances
de investigación. Universidad Autónoma de Nayarit, 2006. ISBN:
978-607-7868-53-8.
53. Rincón-Hernández, C. A.; Sánchez-Pérez, J. de
la L. y Espinosa-García, F. J. Caracterización química
foliar de los árboles de aguacate criollo (Persea americana
var. drymifolia) en los bancos de germoplasma de Michoacán, México.
Rev. Mex. Biodiversidad, 2011, vol. 82, no. 2, pp. 395-412. ISSN: 1870-3453.
54. Ashworth, E. T.; Cheng, H. y Cleg, M. T. Persea. En: Genomic and
Breeding Resources. Tropical and Subtropical Fruits. Chapter 8. Springer-Verlag,
Berlin Heidelberg. 2011. DOI:10.1007/978-3-642-20447-0_8.55.
55. Lahav, E. y Lavi, U. Genetic and Breeding. En: The Avocado. Botany, production
and uses. 2nd Edition. Edited by Schaffer, B. Nigel, B. Wolstenholme and Anthony,
W. Wiley. CABI. ISBN: 978 1 84593 701 0.
56. González, C.; Román, M. I.; Xiquez, X.; Dueñas, J.;
Jiménez, R. y Rodríguez, N. N. Caracterización genética-bioquímica
de 20 cultivares de aguacate (Persea americana Mill.) en Cuba. Revista
Biología, 2002, vol. 6, pp. 49-55. ISSN: 2215-2075.
57. Furnier, G. R.; Cummings, M. P. y Clegg, M. T. Evolution of the avocados
as revealed by DNA restriction fragment variation. Journal of Heredity.
1990, vol. 81, pp. 183-188. ISSN: 0022-1503.
58. Davis, J.; Henderson, D.; Kobayashi, M. y Clegg, M. T. Genealogical relationships
among cultivated avocado as revealed through RFLP analysis. Journal of Heredity,1998,
vol. 89, pp. 319-323. ISSN: 0022-1503.
59. Mhameed, S.; Sharon, D.; Kaufman, D.; Lahav, E.; Hillel, J.; Degani, C.
y Lavi, U. Genetic relationship within avocado (Persea americana Mill.)
cultivars and between Persea species. Theor Appl Genet, 1997,
vol. 94, pp. 279-286. ISSN: 1432-2242.
60. Lavi, U.; Akkaya, M.; Bhagwat, A.; Lahav, E. y Cregan, P. B. Methodology
of generation and characteristics of single sequence repeat DNA markers in avocado
(Persea americana Mill.). Euphytica, 1994, vol. 80, pp. 171-177.
ISSN: 0014-2336.
61. Ashworth, V. E. T. M.; Kobayashi, M. C.; De La Cruz, M. y Clegg, M. T. Microsatellite
markers in avocado (Persea americana Mill.) development of dinucleotide
and trinucleotide markers. Scientia Horticulturae, 2004, vol. 101,
pp. 255-267. ISSN: 0304-4238.
62. Ramírez, I. M.; Fuentes, J. L.; Rodríguez, N. N.; Coto, O.;
Cueto, J.; Becker, D. y Rhode, W. Diversity analysis of Cuban avocado varieties
based on agro-morphological traits and DNA polymorphisms. Journal of Genet
and Breeding, 2005, vol. 59, pp. 241-252. ISSN: 1805-9325.
63. Gutiérrez-Díez, A.; Martínez-de la Cerda, J.; García
Zambrano, E. A.; Iracheta-Donjuan, L.; Ocampo-Morales, J. D. y Cerda-Hurtado,
I. M. Estudio de la diversidad genética del aguacate nativo en Nuevo
León, México. Revista Fitotecnia Mexicana, 2009, vol.
32, pp. 9-18. ISSN: 0187-7380.
64. Cuiris-Pérez, H.; Guillén-Andrade, H.; Pedraza-Santos, M.
E.; López-Medina, J. y Vidales-Fernández, I. Genetic variability
within Mexican race avocado (Persea americana Mill.) Germplasm collection
determined by ISSRs. Revista Chapingo Serie Horticultura, 2009, vol.
15, pp. 169-175. ISSN: 2007-4034.
65. Gross-German, E. y Viruel, M. A. Molecular characterization of avocado germplasm
with a new set of SSR and EST-SSR markers: genetic diversity, population structure,
and identification of race-specific markers in a group of cultivated genotypes.
Tree Genetics and Genomes, 2013, vol. 9, pp. 539-555. ISSN: 1614-2942.
66. Rodríguez, N. N.; Fuentes, J. L.; Coto, O.; Fuentes, V. R.; Ramírez,
I. M.; Becker, D.; Rodríguez, I.; González, C.; Xiqués,
X.; Román, M. I.; Velázquez, B. y Rohde, W. Agro-morphologic traits,
isoenzyme and DNA markers for estimating the polymorphism levels, discriminating
capacity and informativeness in avocado. Revista CENIC Ciencias Biológicas,
2009, vol. 40, no. 1, pp. 63-74. ISSN: 0253-5688.
67. Chanderbali, A. S.; Albert, V. A.; Ashworth, V. E.; Litz, R. E.; Soltis,
D. E. y Soltis, P. S. Persea americana (avocado): bringing ancient
flowers to fruit in the genomics era. Bioessays, 2008, vol. 30, no.
4, pp. 386-396. ISSN: 0265-9247.
68. Ibarra-Laclette, E.; Chamala, S.; Barbazuk, B.; Peréz-Torres, C-A.;
Méndez-Bravo, A.; Hernández, G.; Albert, V. A. y Herrera, E. Avocado
Genome Sequencing Project. Plant and Animal Genome XXI: 2013, January 12-16,
San Diego, CA, USA.
69. Maluszynski, K. N.; Zanten, L. V. y Ahlowalia, B. S. Officially released
mutant varieties. The FAO/IAEA Databse. Mut. Breed. Rev., 2000, vol.
12, pp. 1-12. ISSN: 0212-5730.
70. De la Cruz, E.; Hernández, M.; Rubí, M. y Saavedra, C. Radiosensibility
study on ´Hass´ avocado for breeding purposes. Proceeding of Salvador
Sánchez Colín foundation meeting, CICTAMEX, S. C, Coatepec Harinas,
México, 1993, pp. 121-128.
71. Fuentes, J. L.; Rodríguez, N. N.; Santiago, L.; Valdés, Y.;
Ramirez, I. M.; Vernhe, M.; Guerra, M.; Altanez, S.; Prieto, E. F.; Velázquez,
B.; Rodríguez, J. A.; Fuentes, V. R.; Coto, O.; Cueto, J. y Becker, D.;
Rodhe, W. Advances in avocado mutation breeding programs in Cuba. 2005, IAEA
Report, Research contract No.11671/RO-R1.
72. Bernstein, N.; Meiri, A. y Zilberstaine, M. Root growth of avocado is more
sensitive to salinity than shoot growth. J. Amer. Soc. Hort. Science,
2004, vol. 129, no. 2, pp. 188-192. ISSN: 2327-9788.
73. Mickelbart, M. V.; Melser, S. y Arpaia, M. L. Salinity-Induced Changes in
Ion Concentrations of ‘Hass’ Avocado Trees on Three Rootstocks. Journal
of Plant Nutrition, 2007, vol. 30, pp. 105-122. ISSN: 0190-4167.
74. Pérez-Jiménez, R. M. Significant Avocado Diseases Caused by
Fungi and Oomycetes. Eur. J. Plant Sci. Biotech. 2008, pp. 1-24, ISSN:
1752-3842.
75. Avila-Quezada, G.; Silva-Rojas, H. V. y Teliz-Ortiz, D. First Report of
the Anamorph of Glomerella acutata Causing Anthracnose on Avocado Fruits in
Mexico. Plant Disease, 2007, vol. 91, pp. 1200. ISSN: 0191-2917.
76. Garibaldi, A.; Bertetti, D.; Amatulli, M. T.; Cardinale, J. y Gullino, M.
L. First Report of Postharvest Fruit Rot in Avocado (Persea americana)
Caused by Lasiodiplodia theobromae in Italy. Plant Disease,
2012, vol. 96, 460 pp. ISSN: 0191-2917.
77. McDonald, V. y Eskalen A. Botryosphaeriaceae species associated with avocado
branch canker in California. Plant Disease, 2011, vol. 95, pp.1465-1473.
ISSN: 0191-2917.
78. Twizeyimana, M.; Forster, H.; McDonald, V.; Wang, D. H.; Adaskaveg, J. y
Eskalen, A. Identification and Pathogenicity of Fungal Pathogens Associated
with Stem-End Rot of Avocado in California. Plant Disease. 2013, vol.
97. ISSN: 0191-2917. Disponible en: <http://dx.doi.org/10.1094/PDIS-03-13-0230-RE>.
79. Zea-Bonilla, T.; González-Sánchez, M. A.; Martín-Sánchez,
P. M. y Pérez-Jiménez, R. M. Avocado Dieback Caused by Neofusicoccum
parvum in the Andalucia Region, Spain. Plant Disease, 2007, vol. 91,
1052 pp. ISSN: 0191-2917.
80. Molina-Gayosso, E.; Silva-Rojas, H. V.; García-Morales, S. y Avila-Quezada,
G. First Report of Black Spots on Avocado Fruit Caused by Neofusicoccum parvum
in Mexico. Plant Disease, 2012, vol. 96, 287 pp. ISSN: 0191-2917.
81. Auger, J.; Palma, F.; Pérez, I. y Esterio, M. First Report of Neofusicoccum
australe (Botryosphaeria australis), as a Branch Dieback Pathogen
of Avocado Trees in Chile. Plant Disease, 2013, vol. 97, 842 pp. ISSN:
0191-2917.
82. Mayfield, A. E.; Smith, J. A.; Hughes, M. y Dreaden, T. J. First Report
of Laurel Wilt Disease Caused by a Raffaelea sp. on Avocado in Florida. Plant
Disease, 2008, vol. 92, 976 pp. ISSN: 0191-2917.
83. Fraedrich, S. W.; Harrington, T. C.; Rabaglia, R. J.; Ulyshen, M. D.; Mayfield,
A. E.; Hanula, J. L.; Eickwort, J. M. y Miller, D. R. A. Fungal Symbiont of
the Redbay Ambrosia Beetle Causes a Lethal Wilt in Redbay and Other Lauraceae
in the Southeastern United States. Plant Disease, 2008, vol. 92, pp.
215-224. ISSN: 0191-2917.
84. Montero-Astúa, M.; Saborío-R, G.; Chacón-Díaz,
C.; Garita, L.; Villalobos, W.; Moreira, L.; Hartung, J. S. y Rivera, C. First
Report of Xylella fastidiosa in Avocado in Costa Rica. Plant Disease,
2008, vol. 92, 175 pp. ISSN: 0191-2917.
85. Pruvost, O.; Robène-Soustrade, I.; Ah-You, N.; Jouen, E.; Boyer,
C.; Wuster, G.; Hostachy, B.; Napoles, C. y Dogley, W. First Report in the Seychelles
of Xanthomonas axonopodis Genetic Cluster 9.2 Causing Bacterial Leaf Spot of
Avocado. Plant Disease, 2009, vol. 93, 672 pp. ISSN: 0191-2917.
86. Laviña, A.; Batlle, A.; Garcia Faraco, J. y López Herrera,
C. J. First Report of Stolbur Phytoplasma in Avocado in Spain. Plant Disease,
2002, vol. 86, 692 pp. ISSN: 0191-2917.
87. Zentmyer, G. A. Phytophthora cinnamomi and the disease it causes.
Monogr. No. 10. American Phytopathological Society, St. Paul, Minn.
1980, 392 pp. ISSN: 0191-291.
88. Pegg, K. G.; Coates, L. M.; Korsten, L. y Harding, R. M. Foliar, Fruit and
Soilborne Diseases. The Avocado. Botany, Production and Uses. En: Whyley, A.
W., Schaffer, B. y Wolstenholme, B. N.(Eds.), 2002. CABI publishig, 416 pp.
89. Zamora, V. y Casín, J. C. Caracterización de dos cepas de
Phytophthora aisladas de aguacatero. Resultados de Investigación
RI-72. Acta #6. Consejo Científico IIFT. 1989.
90. Garret, K. A.; Forbes, G. A.; Savary, S.; Skelsey, P.; Sparks, A. H.; Valdivia,
C.; van Bruggen, A. H. C.; Willocquet, L.; Djurle, A.; Duveiller, E.; Eckersten,
H.; Pande, S.; Vera Cruz, C. y Yuen, J. Complexity in climate-change impacts:
an analytical framework for effects mediated by plant disease. Plant Pathology,
2011, vol. 60, pp. 15-30. ISSN: 0032-0862.
Recibido: 2 de
septiembre de 2013
Aceptado: 21 de enero de 2014
Dra.C. Sandra
Pérez Álvarez, Productora Agrícola “El Encanto”, Colonia
Centro, Guasave, Sinaloa, C.P. 81000. Email: perezalvarezsandra2015@gmail.com
