COMUNICACIÓN CORTA
Evaluación in vitro del efecto de fosfolípidos sobre la germinación de semillas de tomate (Lycopersicon esculentum Mill)
In Vitro evaluation of phospholipids effect on germination of tomato seeds (Lycopersicon esculentum Mill)
Dra.C. María del C. Travieso, Dra.C. Oriela Pino, Ms.C. Yaíma Sánchez, Miriam Rojas, Dra.C. Belkis Peteira
Centro Nacional
de Sanidad Agropecuaria (CENSA) Apartado 10, San José de las Lajas; Mayabeque,
Cuba.
RESUMEN
Se evalúo el efecto de una mezcla de fosfolípidos de origen natural, aplicados como sustrato en papel de filtro, sobre la germinación in vitro de semillas de tres cultivares de tomate (Amalia, Campbell 28 y Vita). En todos los casos se evidenció un efecto inductor sobre el crecimiento radicular de las plántulas de las semillas recién germinadas, dados por longitudes de radículas significativamente superiores en los grupos tratados con bajas concentraciones con respecto a los controles. Aunque se observaron longitudes máximas de hipocotilos superiores en este grupo con respecto al control, no existieron diferencias estadísticamente significativas en este indicador del crecimiento. En cuanto a los porcentajes de germinación no hubo un comportamiento homogéneo. Los resultados demuestran las potencialidades del uso de estos compuestos como inductores del crecimiento radicular en plantas y constituyen los primeros obtenidos en Cuba sobre la aplicación exógena de fosfolípidos como bioestimulantes de raíces; abriendo un nuevo camino para el estudio de las funciones biológicas de estas biomoléculas, así como de su aplicación exógena en cultivos de impacto económico y social.
Palabras clave: crecimiento, germinación, hipocotilos, plantas.
ABSTRACT
The effect of a mixture of natural phospholipids applied as substrate on filter paper on in vitro germination of tomato seeds of three varieties (Amalia, Campbell 28 and Vita) was evaluated. In all cases, an inducing effect on the radicular growth of seedlings derived from newly germinated seeds, given by lengths of radicles significantly higher in treated groups compared to controls were showed. Althought hypocotyles maxims longitudes were higher in this group with respect to control, no statistical difference in this growth indicator were evidenced. There was not homogeneous behavior in terms of percentages of germination. These results demonstrate the potential use of these compounds as inducers of radicles growth plant and are the first obtained in Cuba on the exogenous application of phospholipids as roots bio-stimulants, opening a new way to study the biological roles of these biomolecules and its exogenous application in economic and social impact crops.
Key words: growth, germination, hypocotyle, plants.
INTRODUCCIÓN
En Cuba, el cultivo del tomate constituye una prioridad del sector agrícola, por constituir una de las hortalizas de mayor consumo por la población y una importante fuente de materia prima para la industria como renglón exportable (1). Desde hace algunos años, se vienen introduciendo en este cultivo, el uso de biofertilizantes y bioestimulantes del crecimiento vegetal, resaltando con buenos resultados los brasinoesteroides y sus análogos (2), el uso de bacterias rizosféricas del género Azotobacter (3), el humus líquido (4), entre otros. Sin embargo, la disponibilidad de estos productos no cubre toda la demanda actual de los productores. Por esta razón, la búsqueda de productos bioactivos que favorezcan la obtención de los incrementos productivos requeridos, constituye una prioridad en la investigación en este sector. Por otra parte, investigaciones recientes apuntan al estudio de los fosfolípidos y lisofosfolípidos como una nueva clase de reguladores del crecimiento en plantas, debido a las evidencias científicas que muestran que estos compuestos y las enzimas que participan en su catabolismo (fosfolipasas), juegan un importante papel en el crecimiento y desarrollo de las plantas y en la respuesta de estas a los diferentes tipos de estrés (biótico y abiótico) a los que están sometidas, resaltándose que las fosfolipasas A, C y D, algunos lisofosfolípidos y el ácido fosfatídico, son componentes clave de las rutas de señalización de lípidos en las células vegetales que determinan el destino celular (5). Desde hace algunos años, a nivel internacional, han tomado auge investigaciones básicas, para el esclarecimiento de las funciones biológicas de estos compuestos en las células vegetales, así como su implicación en el desarrollo y crecimiento de las plantas (6), e investigaciones aplicadas relacionadas con su uso para mejorar el rendimiento y calidad de las producciones agrícolas (7, 8, 9, 10). No obstante estas evidencias, existe poca información disponible sobre el efecto de fosfolípidos aplicados exógenamente sobre la germinación, el crecimiento y el desarrollo de las plantas (5), por lo que el objetivo del presente trabajo fue evaluar el efecto de fosfolípidos, aplicados exógenamente, sobre la germinación de semillas de tomate.
MATERIALES Y MÉTODOS
Se emplearon semillas
de tomate de tres cultivares (Amalia, Campbell 28 y Vita) provenientes del Instituto
Nacional de Ciencias Agrícolas (INCA). Se evaluaron suspensiones acuosas
de mezclas de fosfolípidos purificados de fuente natural con una composición
mayoritaria de fosfatidilcolina y fosfatidiletanolamina, y presencia de otros
fosfolípidos como esfingomielina, fosfatidilserina, fosfatidilinositol,
fosfatidilglicerol y lisofosfatidilcolina, caracterizados previamente por cromatografía
de placa delgada (11).
El diseño experimental consistió en la evaluación de la
germinación in vitro sobre placas Petri a un grupo control y
tres grupos tratados (tres réplicas por grupo). Se realizó la
siembra de 30 semillas por placa empleando papel de filtro como sustrato humectado
con 5 mL de agua (grupo control) o con suspensiones de fosfolípidos a
concentraciones de 0,1; 1 y 10 mg mL-1 (grupos tratados). Se realizó
observación diaria durante los siete días de duración de
la prueba para la determinación del número de semillas germinadas,
tomando como indicador de germinación cuando la longitud de la radícula
sobrepasó los 2 mm de longitud. Trascurrido este tiempo se realizó
medición directa de las longitudes de las radículas e hipocotilos
de cada semilla germinada para cada uno de los grupos, así como conteo
de números de hojas verdaderas por plántula. Se realizó
el cálculo de los porcentajes de germinación (G) a los siete días
(12). Los datos experimentales obtenidos se procesaron estadísticamente
mediante un análisis de varianza de clasificación simple, y las
medias se compararon mediante la prueba de comparación de rangos múltiples
de Duncan, a una probabilidad de error al 5 % (p<0,05), usando el paquete
estadístico SAS 9.0.
RESULTADOS Y DISCUSIÓN
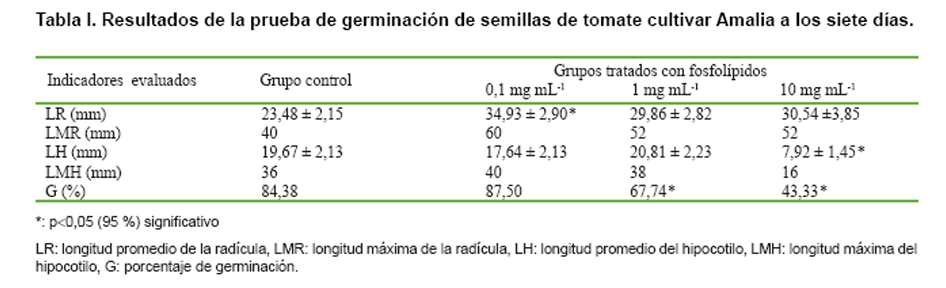
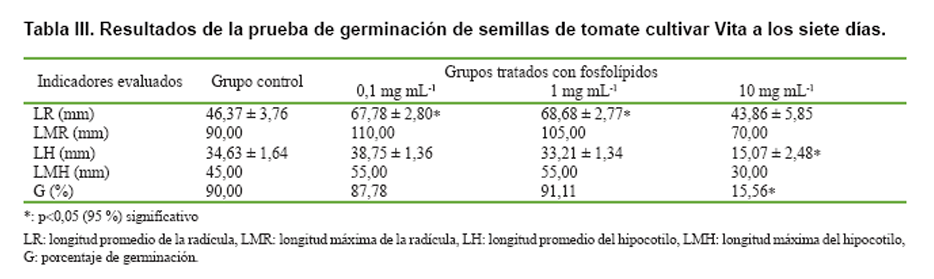
Los resultados (Tablas I, II y III) demostraron que la mezcla evaluada no tuvo un efecto significativo sobre la germinación en los grupos tratados con bajas concentraciones con respecto a los controles, excepto en el cultivar Amalia para una concentración de 1 mg mL-1. Sin embargo, los grupos tratados con altas concentraciones mostraron inhibición del proceso germinativo que difirieron estadísticamente de los controles, mostrando una relación inversamente proporcional entre los porcentajes de germinación (G) y la concentración de fosfolípidos. Estos resultados apoyan la relación declarada por algunos autores, entre el metabolismo de los fosfolípidos y el mecanismo de acción de las fitohormonas (5, 13), influyendo en procesos fisiológicos de las plantas a bajas concentraciones (14).

Por otra parte, la mezcla evaluada tiene entre sus componentes mayoritarios
la fosfatidilcolina y la fosfatidiletanolamina que constituyen, a su vez, los
fosfolípidos fundamentales en las membranas de plantas, a partir de los
cuales se forma el ácido fosfatídico, que constituye el principal
producto de degradación enzimática de estas clases de fosfatidilfosfolípidos.
Se ha demostrado que estos compuestos juegan un papel fundamental en la señalización
del ácido abscísico durante el proceso de germinación de
las semillas (15), lo que corrobora la estrecha relación, apuntada anteriormente,
entre el metabolismo y la señalización de estos compuestos y el
mecanismo de acción hormonal en plantas (5). Aunque en los últimos
años ha existido un avance notable en el conocimiento de las funciones
biológicas de los fosfolípidos en las células vegetales,
en la señalización de estos en plantas y la relación con
los procesos de desarrollo y crecimiento (6, 13, 16), aún no están
completamente dilucidados los mecanismos fisiológicos y todos los roles
biológicos de cada una de las diferentes clases de fosfolípidos
en este tipo de célula. Menos aún, sobre la ventaja del uso exógeno
de estos importantes compuestos, que aunque promisorio su estudio, como apuntara
Cowan, está aún en sus inicios (5).
Estos resultados corroboran otros informados en la literatura que demostraron
la relación que existe entre los niveles de fosfolípidos de las
membranas de las semillas de tomate, con la calidad y viabilidad de estas, sin
influir directamente en la velocidad de germinación, informándose,
incluso, pérdidas de viabilidad relacionadas con la disminución
de los niveles de fosfatidilcolina, que constituye la clase de fosfolípidos
mayoritaria en este tipo de semillas (17) y en la mezcla evaluada. Por otra
parte, los fosfolípidos en los sistemas vivos (semillas viables), se
convierten en fuentes de fósforo orgánico, por la acción
de las fosfolipasas C y D, con implicación directa en todas las fases
de desarrollo y especialmente en la fase inicial de germinación de las
semillas y formación de las plántulas (18, 19, 20).
Los resultados de las longitudes de la radícula (LR) como indicador del
crecimiento de las plántulas recién germinadas mostraron, en todos
los cultivares, un aumento estadísticamente significativo en los grupos
tratados a bajas concentraciones, con respecto a los controles (excepto en el
cultivar Amalia para una concentración de 1 mg mL-1), mientras
que a la mayor concentración evaluada no se evidenció afectación
de este indicador del crecimiento con respecto a los controles. Otros autores
han demostrado la implicación de la fosfatidilcolina con el crecimiento
de las raíces, confirmando como una mutación del gen XIPOTL1
que codifica para la S-adenosil-L-metionina:fosfoetanolamina N-metiltransferasa
que constituye una enzima crítica en la biosíntesis de la fosfatidilcolina,
resulta en la afectación del crecimiento de las raíces primarias
y de las células epidérmicas, debido a muerte celular inducida
por disminución del contenido de fosfatidilcolina (16, 21). Por otra
parte, la mezcla evaluada contiene fosfolípidos que constituyen sustratos
de fosfolipasas, específicamente de la fosfolipasa A2 cuya función
fundamental ha estado asociada a la regulación de la liberación
del ácido linoleico para la biosíntesis del ácido jasmónico,
y su implicación en los procesos de germinación, crecimiento de
las plántulas, crecimiento mediado por auxina tales como la expansión
celular y la respuesta a estrés (5), lo que corrobora las potencialidades
de estos compuestos fosfolipídicos como inductores del crecimiento radicular
de las plántulas (16). Sin embargo, no se observaron diferencias en las
longitudes de los hipocotilos (LH) ni en la presencia de hojas verdaderas en
este nivel de concentración con respecto al control.
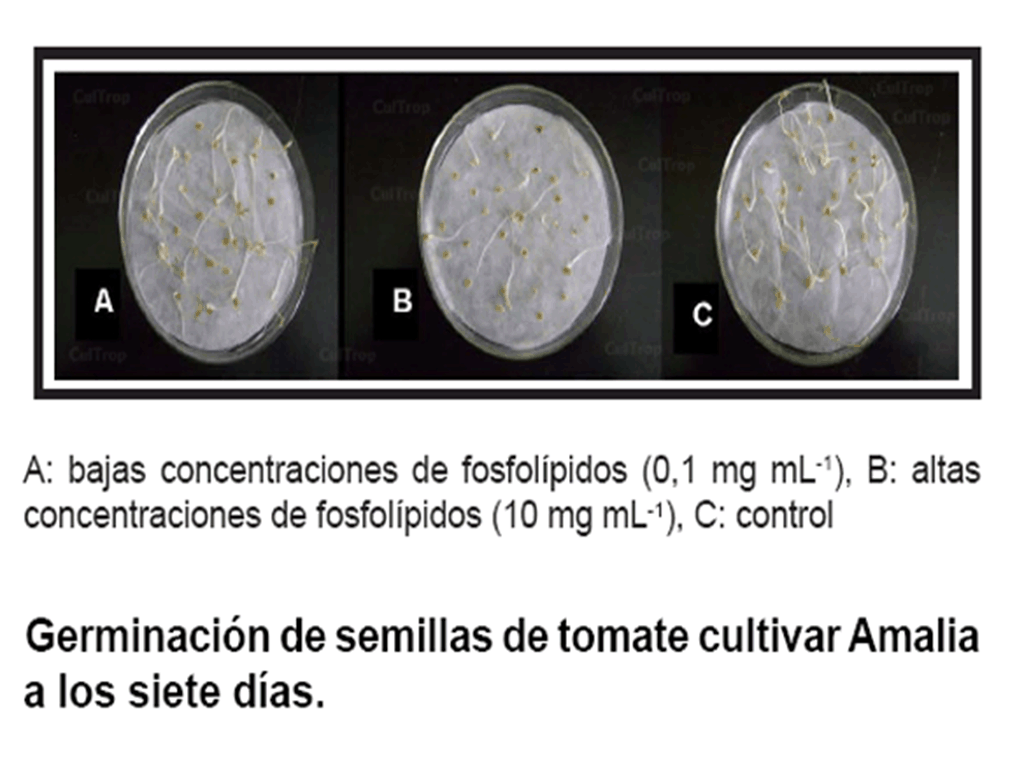
Otro resultado interesante lo constituye la demostración de que altas
concentraciones de fosfolípidos (10 mg mL-1) provocaron un
efecto inhibitorio sobre la germinación, y un menor crecimiento de las
plántulas, dado por valores de LH estadísticamente inferiores
con respecto al resto de los grupos tratados y a los controles, así como
la ausencia de hojas verdaderas (figura).
Además de
estos fosfatidilfosfolípidos, que constituyen sustratos de familias de
enzimas fosfolipasas (A, C, D) con implicación directa en el destino
celular y en los procesos de desarrollo y crecimiento (6), en la mezcla evaluada
están presentes otros componentes fosfolipídicos interconvertibles
en otros precursores y segundos mensajeros de gran importancia en los procesos
germinativos, por lo que constituye un reto en nuestras investigaciones dilucidar
el efecto individual y el mecanismo de acción de cada uno de los fosfolípidos,
el sinergismo o antagonismo de la mezcla evaluada, así como el efecto
inhibitorio sobre la germinación y el crecimiento evidenciado a altos
niveles de fosfolípidos.
Estos resultados, aunque constituyen evidencias preliminares del efecto bioestimulante
de la mezcla de fosfolípidos aplicada exógenamente, demuestran
la importancia del conocimiento de los niveles requeridos para lograr el efecto
óptimo y la importancia de su evaluación en los diferentes estadios
del desarrollo de las plantas.
De modo general, se han realizado avances recientes en el conocimiento del metabolismo
y funciones de los fosfolípidos endógenos y sus catabolitos, que
muestran que fosfolípidos y fosfolipasas juegan un papel importante en
el desarrollo normal de la planta y en su respuesta a estrés abiótico
y biótico. En comparación, existe poca información disponible
sobre el uso exógeno de fosfolípidos. Nuevas evidencias sugieren
que estos compuestos aplicados exógenamente ejercen profundos efectos
sobre el crecimiento de la planta y nuestros resultados aportan elementos sobre
las posibilidades de uso de estas sustancias como reguladores del crecimiento
vegetal.
CONCLUSIONES
Con estos resultados se puede concluir que la mezcla de fosfolípidos evaluada posee un efecto inductor sobre el crecimiento radicular de las plántulas de las semillas recién germinadas, cuando esta se aplica como sustrato a bajas concentraciones. De igual manera no existió efecto significativo sobre el porcentaje de germinación y no hubo un comportamiento homogéneo en este indicador en los cultivares estudiados. Los resultados demuestran las potencialidades del uso de estos compuestos como inductores del crecimiento en plantas.
BIBLIOGRAFÍA
1. Companioni,
N.; Delgado, R. y González, M. Décimo Seminario Nacional de la
Agricultura Urbana y Primero de la Suburbana. Agricultura Orgánica. 2009.
2. González, F.; Casanova, A.; Hernández, A.; Méndez, M.;
González, R. y Delgado, A. Efecto de la aplicación de Biobras-16
en la producción de plántulas injertadas de tomate (Lycopersicon
esculentum Mill). Temas de Ciencia y Tecnología, 2006,
vol.10, no. 30, pp. 53-63. ISSN: 2007-0977.
3. Acosta, M. Efecto de la aplicación del Azotobacter chroococcum
sobre el crecimiento y la productividad del tomate. En: IV Simposio Internacional
de Botánica. La Habana, Cuba. 1993. 222 pp.
4. Arteaga, M.; Garcés, N.; Guridi, F.; Pino, J. A.; López, A.;
Menéndez, J. L. y Cartaya, O. Evaluación de lasaplicaqciones foliares
de humus líquido en el cultivo del tomate (Lycopersicon esculentum
Mill) var. Amalia en condiciones de producción. Cultivos Tropicales,
2006, vol. 27, no. 3, pp. 95-101. ISSN: 1819-4087.
5. Cowan, A. K. Phospholipids as plant growth regulators. Plant Growth Regulation,
2006, no. 48, pp. 97-109. ISSN: 1573-5087.
6. Munnik, T.; Irvine, R. F. y Musgrave, A. Phospholipid signalling in plants.
Biochimica et Biophysica Acta, 1998, no. 1389, pp. 222-272. ISSN: 0006-3002.
7. Kopp, H.; Weiss, A. y Schlue, R. Use of phospholipids to improve plant growth.
World patent WO012685. 1996.
8. Hong, J. H.; Hwang, S. K.; Chung, G. H. y Cowan, A. K. Influence of lysophosphatidylethanolamine
application on fruit quality of Thompson Seedless grapes. Journal of Applied
Horticulture, 2007, vol. 9, pp. 112-4. ISSN: 0972-1045.
9. Hong, J. H.; Chung, G. H. y Cowan, A. K. Delayed leaf senescence by exogenous
lyso phosphatidylethanolamine: Towards a mechanism of action. Plant Physiol
and Biochem, 2009, vol. 47, pp. 526- 534. ISSN: 0981-9428.
10. Cowan, A. K. Plant growth promotion by 18:0-lyso-phosphatidylethanolamine
involves senescence delay. Plant Signaling and Behavior, 2009, vol.
4, no. 4, pp. 324-327. ISSN: 1559-2324.
11. Travieso, M. C. y Betancourt, A. Validación de un método de
separación y cuantificación de fosfolípidos por Cromatografía
de Capa Delgada. Revista Cubana de Química, 2001; vol. 13, no.
2, 83 pp. ISSN: 2224-5421.
12. Vadillo, G.; Suni, M. y Cano, A. Viabilidad y germinación de semillas
de Puya raimondii Harás. Revista Peruana de Biología,
2004, vol. 11, no. 1, pp. 71-78. ISSN: 1727-9933.
13. Xue, H. W.; Chen, X. y Li, G. Involvement of phospholipid signaling in plant
growth and hormone effects. Current Opinion in Plant Biology, 2007,
vol. 10, pp. 483-489. ISSN: 1369-5266.
14. Davies, P. J. The Plant Hormones: Their Nature, Occurrence, and Functions.
Plant Hormones. Ed. 3. 2010; Part A: pp. 1-15.
15. Katagiri, T.; Ishiyama, K.; Kato, T.; Tabata, S.; Kobayashi, M. y Shinozaki,
K. An important role of phosphatidic acid in ABA signalling during germination
in Arabidopsis thaliana. The Plant Journal, 2005, vol. 43, pp. 107-117.
ISSN: 1365-313X.
16. Xue, H. W.; Chen, X. y Mei, Y. Function and regulation of phospholipid signalling
in plants. Biochemical Journal, 2009, vol. 421, no. 2, pp. 145-156.
ISSN: 1470-8728.
17. Adele, F. y Coolbear, P. Changes in the membrane phospholipid composition
of tomato seeds accompanying loss of germination capacity caused by controlled
deteriotion. The Journal of Experimental Botany, 1984, vol. 35, pp.
1764-1770. ISSN: 1460-2431.
18. White, P. J. y Hammond, J. P. Phosphorous nutrition of terrestrial plants.
Plant Ecophysiology, 2008, vol. 7, pp. 51-81. ISSN: 1572-5561.
19. Nakamura, Y.; Awai, K.; Masuda, T.; Yoshioka, Y.; Takamiya, K. I. y Ohta,
H. A novel phosphatidylcholine-hydrolyzing phospholipase C induced by phosphate
starvation in Arabidopsis. The Journal of Biological Chemistry, 2005,
vol. 280, pp. 7469-7476. ISSN: 1083-351X.
20. Nakamura, Y.; Koizumi, R.; Shui, G.; Shimojima, M.; Wenk, M. R.; Ito, T.
y Ohta, H. Arabidopsis lipins mediate eukaryotic pathway of lipid metabolism
and cope critically with phosphate starvation. Proceedings of the National
Academy of Sciences USA, 2009, vol. 106, pp. 20978-20983. ISSN: 1091-6490.
21. Cruz, R. A.; López, B. J.; Ramírez, P. G.; Zurita, S. A.;
Sánchez, C. L.; Ramírez, C. E.; González, O. E. y Herrera,
E. L. The xipotl mutant of Arabidopsis reveals a critical role for phospholipid
metabolism in root system development and epidermal cell integrity. Plant
Cell, 2004, vol. 16, pp. 2020-2034. ISSN: 1532-298X.
Recibido: 26 de
abril de 2014
Aceptado: 8 de diciembre de 2014
Dra.C. María del C. Travieso, Centro Nacional de Sanidad Agropecuaria (CENSA) Apartado 10, San José de las Lajas; Mayabeque, Cuba. Email: oriela@censa.edu.cu