Descomposición del residuo de cosecha de la caña de azúcar por una cepa fúngica autóctona de Trichocladium pyriforme
Contenido principal del artículo
Resumen
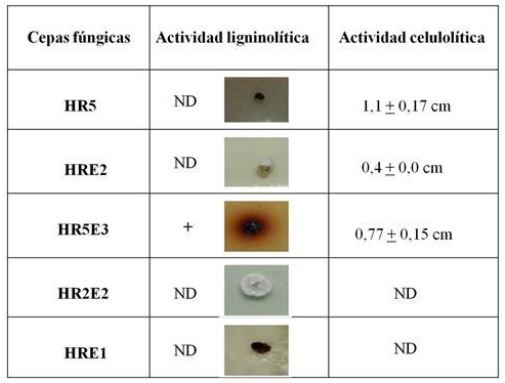
Durante el sistema de cosecha en verde de la caña de azúcar, se produce una gran cantidad de residuo agrícola de cosecha que puede dejarse como cobertura sobre el suelo, retirarse del campo o incorporarse en el perfil, según las características agroecológicas de cada área. Es importante descomponer rápidamente la cobertura con residuo en zonas donde resulta perjudicial para la producción del cañaveral. Una de las alternativas para acelerar la descomposición natural del residuo es la utilización de hongos lignocelulolíticos. El objetivo de este trabajo fue aislar cepas fúngicas autóctonas, a partir de la conservación del residuo agrícola de cosecha (RAC) de la caña de azúcar, seleccionar y caracterizar en forma cultural, morfológica y molecular aquellas que presenten mayor potencial para acelerar la descomposición del residuo de la cosecha en verde del cañaveral. A partir de fragmentos de residuo recién cosechado, se aislaron cinco cepas fúngicas autóctonas. Se evaluó la actividad celulolítica y ligninolítica in vitro, utilizando carboximetilcelulosa y guaiacol, como sustratos, respectivamente. La cepa HR5E3 fue la única capaz de descomponer la celulosa y la lignina. Esta cepa, se caracterizó en forma cultural, morfológica y molecular como Trichocladium pyriforme y produjo enzimas del grupo de la lignina peroxidasa, polifenol oxidasas y lacasas. En bioensayos de fermentación en sustrato sólido, dicha cepa aceleró la descomposición del residuo mediante crecimiento diáuxico con glucosa. Trichocladium pyriforme, cepa HR5E3 podría utilizarse como un bioinoculante capaz de degradar la lignocelulosa, y evitar los efectos perjudiciales que la cobertura inalterada del residuo agrícola podría tener sobre el desarrollo del cañaveral.
Detalles del artículo

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes de la Licencia CC Reconocimiento-NoComercial 4.0 Internacional (CC BY-NC 4.0):
Usted es libre de:
- Compartir — copiar y redistribuir el material en cualquier medio o formato
- Adaptar — remezclar, transformar y crear a partir del material
El licenciador no puede revocar estas libertades mientras cumpla con los términos de la licencia.
Bajo las condiciones siguientes:
- Reconocimiento — Debe reconocer adecuadamente la autoría, proporcionar un enlace a la licencia e indicar si se han realizado cambios. Puede hacerlo de cualquier manera razonable, pero no de una manera que sugiera que tiene el apoyo del licenciador o lo recibe por el uso que hace.
- NoComercial — No puede utilizar el material para una finalidad comercial.
- No hay restricciones adicionales — No puede aplicar términos legales o medidas tecnológicas que legalmente restrinjan realizar aquello que la licencia permite.
La revista no se responsabiliza con las opiniones y conceptos emitidos en los trabajos, son de exclusiva responsabilidad de los autores. El Editor, con la asistencia del Comité de Editorial, se reserva el derecho de sugerir o solicitar modificaciones aconsejables o necesarias. Son aceptados para publicar trabajos científico originales, resultados de investigaciones de interés que no hayan sido publicados ni enviados a otra revista para ese mismo fin.
La mención de marcas comerciales de equipos, instrumentos o materiales específicos obedece a propósitos de identificación, no existiendo ningún compromiso promocional con relación a los mismos, ni por los autores ni por el editor.
Citas
Fandos C, Scandaliaris P, Carreras- Baldrés J, Soria F, Giardina J. Área cosechable y producción de caña de azúcar y azúcar para la zafra 2020 en Tucumán. 2020;190:3-5.
Digonzelli PA, Romero ER, Alonso L, Ullivarri F, Quinteros R, Scandaliaris J, et al. Assessing a sustainable sugarcane production system in Tucumán, Argentina. Part 1: Dynamics of sugarcane harvest residue (trash) decomposition. Revista industrial y agrícola de Tucumán. 2011;88(1):1-12.
Carvalho JLN, Nogueirol RC, Menandro LMS, Bordonal R de O, Borges CD, Cantarella H, et al. Agronomic and environmental implications of sugarcane straw removal: a major review. GCB Bioenergy. 2017;9(7):1181-95. doi:https://doi.org/10.1111/gcbb.12410
Cherubin MR, Oliveira DM da S, Feigl BJ, Pimentel LG, Lisboa IP, Gmach MR, et al. Crop residue harvest for bioenergy production and its implications on soil functioning and plant growth: A review. Scientia Agricola. 2018;75(3):255-72.
Marzi M, Shahbazi K, Kharazi N, Rezaei M. The Influence of Organic Amendment Source on Carbon and Nitrogen Mineralization in Different Soils. Journal of Soil Science and Plant Nutrition. 2020;20(1):177-91. doi:10.1007/s42729-019-00116-w
Maza M, Pajot HF, Amoroso MJ, Yasem MG. In-vitro degradation of Czapek and molasses amended post-harvest sugarcane residue by lignocellulolytic fungal strains. International Biodeterioration & Biodegradation. 2015;104:118-22. doi:10.1016/j.ibiod.2015.05.021
Maza M, Medina M, Plasencia AM, Amoroso MJ, Yasem MG. Fungal inoculation effect on post-harvest sugarcane residue decomposition under field conditions. Revista agronómica del noroeste argentino. 2018;38(2):65-73.
Chukwuma OB, Rafatullah M, Tajarudin HA, Ismail N. Lignocellulolytic Enzymes in Biotechnological and Industrial Processes: A Review. Sustainability. 2020;12(18):7282. doi:10.3390/su12187282
Ferreira JA, Mahboubi A, Lennartsson PR, Taherzadeh MJ. Waste biorefineries using filamentous ascomycetes fungi: Present status and future prospects. Bioresource Technology. 2016;215:334-45. doi:10.1016/j.biortech.2016.03.018
Kantharaj P, Boobalan B, Sooriamuthu S, Mani R. Lignocellulose degrading enzymes from fungi and their industrial applications. Int. J. Curr. Res. Rev. 2017;9(21):1-12.
Nguyen KA, Wikee S, Lumyong S. Brief review: lignocellulolytic enzymes from polypores for efficient utilization of biomass. Mycosphere. 2018;9(6):1073-88.
Ostengo S, Espinosa MA, Díaz JV, Chavanne ER, Costilla DD, Cuenya MI. Relevamiento de la distribución de variedades y de otras tecnologías aplicadas en el cultivo de caña de azúcar en la provincia de Tucumán: campaña 2016/2017. Gac. Agroindustrial EEAOC. 2018;81:14.
Sehgal J, Asha BM, Vardhan A, Siddalingeshwara KG. An Approach on Screening, Production and Characterization of Laccase from Fusarium. Journal of Current Pharma Research. 2020;10(2):3673-9.
Cruz-Hernández M. Avances de Investigación en Inocuidad de alimentos. In: Evaluación de hongos filamentosos para la producción de enzimas celulolíticas [Internet]. 2019. Available from: https://www.researchgate.net/publication/344359381_Evaluacion_de_hongos_filamentosos_para_la_produccion_de_enzimas_celuloliticas
Gaillard C, Strauss F. Ethanol precipitation of DNA with linear polyacrylamide as carrier. Nucleic Acids Research. 1990;18(2):378.
Ahmed PM, Pajot HF, de Figueroa LIC, Gusils CH. Sustainable bioremediation of sugarcane vinasse using autochthonous macrofungi. Journal of Environmental Chemical Engineering. 2018;6(4):5177-85. doi:10.1016/j.jece.2018.08.007
Pointing SB. Qualitative methods for the determination of lignocellulolytic enzyme production by tropical fungi. Fungal diversity. 1999;2:17-33.
Fonseca MI, Zapata PD, Villalba LL, Fariña JI. Characterization of the oxidative enzyme potential in wild white rot fungi from the subtropical forest of Misiones (Argentina). Acta biològica colombiana. 2015;20(1):47-56.
Goering HK, Soest PJV. Forage Fiber Analyses (apparatus, Reagents, Procedures, and Some Applications). Vol. 379. U.S. Agricultural Research Service; 1970. 24 p.
Dixon M. Trichocladium pyriformis sp. nov. Transactions of the British Mycological Society. 1968;51(1):160-4.
de Souza RSC, Okura VK, Armanhi JSL, Jorrín B, Lozano N, Da Silva MJ, et al. Unlocking the bacterial and fungal communities assemblages of sugarcane microbiome. Scientific Reports. 2016;6(1):1-15.
Miura T, Niswati A, Swibawa IG, Haryani S, Gunito H, Shimano S, et al. Diversity of Fungi on Decomposing Leaf Litter in a Sugarcane Plantation and Their Response to Tillage Practice and Bagasse Mulching: Implications for Management Effects on Litter Decomposition. Microbial Ecology. 2015;70(3):646-58. doi:10.1007/s00248-015-0620-9
Spennati F, Ricotti A, Mori G, Siracusa G, Becarelli S, Gregorio SD, et al. The role of cosubstrate and mixing on fungal biofilm efficiency in the removal of tannins. Environmental Technology. 2020;41(26):3515-23. doi:10.1080/09593330.2019.1615128
Sen SK, Raut S, Bandyopadhyay P, Raut S. Fungal decolouration and degradation of azo dyes: A review. Fungal Biology Reviews. 2016;30(3):112-33. doi:10.1016/j.fbr.2016.06.003
Beary TP, Boopathy R, Templet P. Accelerated decomposition of sugarcane crop residue using a fungal-bacterial consortium. International Biodeterioration & Biodegradation. 2002;50(1):41-6. doi:10.1016/S0964-8305(02)00056-2
Chu D, Barnes DJ. The lag-phase during diauxic growth is a trade-off between fast adaptation and high growth rate. Scientific Reports. 2016;6(1):1-15. doi:10.1038/srep25191
Durrant LR. Biodegradation of lignocellulosic materials by soil fungi isolated under anaerobic conditions. International Biodeterioration & Biodegradation. 1996;37(3):189-95. doi:10.1016/S0964-8305(96)00022-4
Pavarina EC, Durrant LR. Growth of lignocellulosic-fermenting fungi on different substrates under low oxygenation conditions. Applied Biochemistry and Biotechnology. 2002;98(1):663-77. doi:10.1385/ABAB:98-100:1-9:663