Manejo de hongos fitopatógenos en Oryza sativa con la aplicación de Trichoderma asperellum
Contenido principal del artículo
Resumen
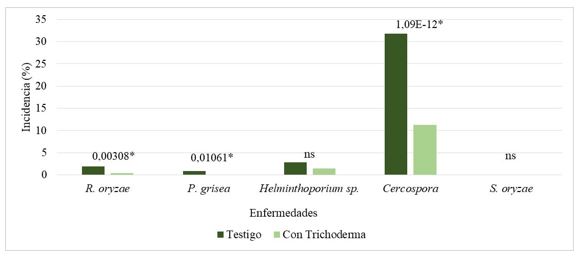
Las enfermedades fúngicas en el cultivo del arroz (Oryza sativa Lin.) están consideradas entre las principales causas de los bajos rendimientos del cereal. Numerosos estudios indican que las aplicaciones al suelo de cepas de Trichoderma asperellum Samuels, Lieckfeldt & Nirenberg en campos destinados al cultivo del arroz, son promisorias para el control de numerosos hongos fitopatógenos. El objetivo del trabajo fue evaluar el efecto de la cepa Ta. 78 de T. asperellum frente a las enfermedades más importantes del cultivo del arroz, en condiciones de campo. Para ello, se asperjó al suelo la cepa Ta. 78 de T. asperellum, en un sistema de terrazas durante la preparación de suelo, y se utilizó una terraza sin asperjar como testigo de producción. Se evaluó la severidad y la incidencia de las principales enfermedades causadas por los hongos, así como el número de plantas, hijos y panículas por m2. Los hongos que más afectaciones causaron al arroz fueron, R. solani, Helminthosporium sp. y Cercospora sp. La incidencia y la severidad de las enfermedades evaluadas en los tratamientos con T. asperellum disminuyó, significativamente, con respecto al tratamiento control, independientemente del momento de la evaluación. Por otro lado, el número de hijos y de espigas fue significativamente mayor en la parcela tratada con el control biológico.
Detalles del artículo

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes de la Licencia CC Reconocimiento-NoComercial 4.0 Internacional (CC BY-NC 4.0):
Usted es libre de:
- Compartir — copiar y redistribuir el material en cualquier medio o formato
- Adaptar — remezclar, transformar y crear a partir del material
El licenciador no puede revocar estas libertades mientras cumpla con los términos de la licencia.
Bajo las condiciones siguientes:
- Reconocimiento — Debe reconocer adecuadamente la autoría, proporcionar un enlace a la licencia e indicar si se han realizado cambios. Puede hacerlo de cualquier manera razonable, pero no de una manera que sugiera que tiene el apoyo del licenciador o lo recibe por el uso que hace.
- NoComercial — No puede utilizar el material para una finalidad comercial.
- No hay restricciones adicionales — No puede aplicar términos legales o medidas tecnológicas que legalmente restrinjan realizar aquello que la licencia permite.
La revista no se responsabiliza con las opiniones y conceptos emitidos en los trabajos, son de exclusiva responsabilidad de los autores. El Editor, con la asistencia del Comité de Editorial, se reserva el derecho de sugerir o solicitar modificaciones aconsejables o necesarias. Son aceptados para publicar trabajos científico originales, resultados de investigaciones de interés que no hayan sido publicados ni enviados a otra revista para ese mismo fin.
La mención de marcas comerciales de equipos, instrumentos o materiales específicos obedece a propósitos de identificación, no existiendo ningún compromiso promocional con relación a los mismos, ni por los autores ni por el editor.
Citas
Martínez S, Bao L, Escalante F. Manual de identificación de enfermedades y plagas en el cultivo de arroz. Instituto Nacional de Investigación Agropecuaria. 2018;(116).
Pérez_Iglesias HI, García-Batista RM. Principales enfermedades que afectan al cultivo del arroz en Ecuador y alternativas para su control. Revista Científica Agroecosistemas. 2018;6(1):16-27.
Bhumi-Narsimha R, Kamma-Venkata S, Amballa H. In vitro screening for antagonistic potential of seven species of Trichoderma against different plant pathogenic fungi. Research Journal of Biology. 2014;2:29-36.
Companioni González B, Domínguez Arizmendi G, García Velasco R, Companioni González B, Domínguez Arizmendi G, García Velasco R. Trichoderma: su potencial en el desarrollo sostenible de la agricultura. Biotecnología Vegetal. 2019;19(4):237-48.
Coca BM, Infante D, Reyes Y, González I, Peteira B, Arias Y, et al. Bases científico - metodológicas para la selección, caracterización y uso de aislamientos de trichoderma como agente de control biológico del tizón de la vaina (rhizoctonia solani kühn) en arroz. Anales de la Academia de Ciencias de Cuba [Internet]. 2017;7(1). [cited 14/09/2022] Available from: http://revistaccuba.sld.cu/ index.php/revacc/article/view/470
Singh U, Singh S, Malviya D, Chaurasia R, Imran M, Rai J. Harnessing biocontrol potential of Trichoderma harzianum for control of Meloidogyne incognita in tomato. Indian Phytopathol. 2017;70:331-5.
De Palma M, Salzano M, Villano C, Aversano R, Lorito M, Ruocco M, et al. Transcriptome reprogramming, epigenetic modifications and alternative splicing orchestrate the tomato root response to the beneficial fungus Trichoderma harzianum. Horticulture Research [Internet]. 2019;6(5). [cited 14/09/2022] doi:10.1038/s41438-018-0079-1.
Infante D, Martínez B, Peteira B, Reyes Y, Herrera A. Identificación molecular y evaluación patogénica de trece aislamientos de Trichoderma spp. frente a Rhizoctonia solani Kühn. Biotecnología Aplicada. 2013;30(1):17-22.
Hernández A, Pérez J, Bosch D, Castro N. Clasificación de los suelos de Cuba 2015. Mayabeque, Cuba: Ediciones INCA; 2015.
MINAG. Instructivo Técnico para el cultivo del arroz. LaHabana: Instituto de Investigaciones del Arroz; 2015 p.115.
Estándar. Evaluation System for Rice (SES) [Internet]. International Rice Research Institute (IRRI); 2016. Available from: http://www.knowledgebank.irri.org/images/ docs/rice-standard-evaluation-system.pdf
Townsend GR. Methods for estimating losses caused bydiseases in fungicide experiments. Plant Disease Reporter. 1943;27:340-3.
Folguera-Montiel M, Rodríguez-Morales S, Herrera-Isla L,Sánchez-Rodríguez R. Influencia de diferentes métodos de plantación en la incidencia de las pudriciones radicales de la yuca (“Manihot esculenta Crantz”). Cuadernos de fitopatología: Revista técnica de fitopatología y entomología. 2011;28(108):23-7.
Cruz-Triana A, Rivero-González D, Martínez-Coca B,Echevarría-Hernández A, Tania-Rodríguez A. Evaluación de la actividad antifúngica de Trichoderma asperellum Samuels ante patógenos fúngicos que afectan al cultivo de la soya (Glycine max L.). Cultivos Tropicales. 2017;38(4):15-21.
Cruz-Triana A, Rivero-González D, Infante-Martínez D,Echevarría-Hernández A, Martínez-Coca B, Cruz-Triana A, et al. Manejo de hongos fitopatógenos en Phaseolus vulgaris L. con la aplicación de Trichoderma asperellum Samuels, Lieckfeldt & Nirenberg. Revista de Protección Vegetal [Internet]. 2018;33(3). [cited 14/09/2022] Available from: http://scielo.sld.cu/scielo.php?script=sci_abstract&p id=S1010-27522018000300004&lng=es&nrm=iso&tlng=en
Dotson BR, Soltan D, Schmidt J, Areskoug M, Rabe K, Swart C, et al. The antibiotic peptaibol alamethicin from Trichoderma permeabilises Arabidopsis root apical meristem and epidermis but is antagonised by cellulaseinduced resistance to alamethicin. BMC Plant Biology. 2018;18(1):165. doi:10.1186/s12870-018-1370-x16
Pineda-Insuasti JA, Benavides-Sotelo EN, Duarte-TrujilloAS, Burgos-Rada CA, Soto-Arroyave CP, Pineda-Soto CA, et al. Producción de biopreparados de Trichoderma spp: una revisión. ICIDCA. Sobre los Derivados de la Caña de Azúcar. 2017;51(1):47-52.
Malmierca MG, Barua J, McCormick SP, Izquierdo-BuenoI, Cardoza RE, Alexander NJ, et al. Novel aspinolide production by Trichoderma arundinaceum with a potential role in Botrytis cinerea antagonistic activity and plant defence priming. Environmental Microbiology.
;17(4):1103-18. doi:https://doi.org/10.1111/1462-2920. 12514
Companioni-González B, Domínguez-Arizmendi G, García-Velasco R, Companioni-González B, DomínguezArizmendi G, García-Velasco R. Trichoderma: su potencial en el desarrollo sostenible de la agricultura. Biotecnología Vegetal. 2019;19(4):237-48.
Benhamou N. Elicitor-Induced Resistance in TomatoPlants Against Fungal Pathogens: Ultrastructure and Cytochemistry of the Induced Response. Scanning Microscopy [Internet]. 1995;9(3). Available from: https:// digitalcommons.usu.edu/microscopy/vol9/iss3/22
Cortés C, Gutiérrez A, Olmedo V, Inbar J, Chet I, HerreraEstrella A. The expression of genes involved in parasitism by Trichoderma harzianum is triggered by a diffusible factor. Molecular and General Genetics MGG. 1998;260(2):218-25. doi:10.1007/s004380050889
Schirawski J, Perlin MH. Plant-Microbe Interaction 2017The Good, the Bad and the Diverse. International Journal of Molecular Sciences. 2018;19(5):1374. doi:10.3390/ ijms19051374