Hongos micorrizógenos arbusculares y niveles de abonado orgánico en la obtención de posturas de coco
Contenido principal del artículo
Resumen
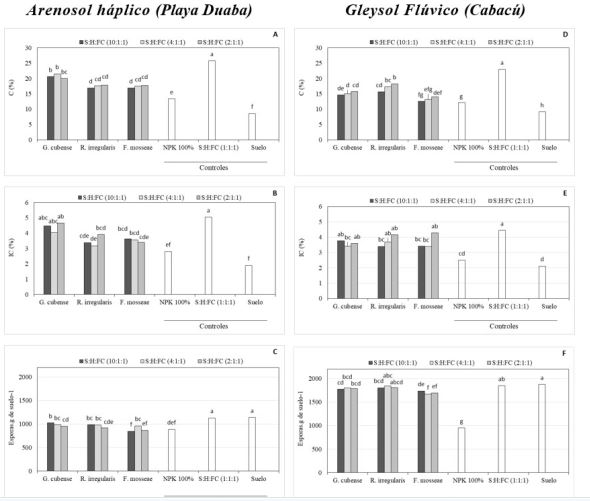
Los hongos micorrízicos arbusculares (HMA) desempeñan una importante función, al contribuir de forma más eficiente a la supervivencia y crecimiento de las posturas, al jugar un papel crucial en la nutrición de las plantas. El objetivo del presente estudio fue evaluar tres cepas de HMA inoculadas en plántulas de coco “Indio Verde-1”, en combinación con niveles de abonado orgánico en dos suelos, Arenosol háplico (ARh) y Gleysol Flúvico háplico (GFLh), en Baracoa, GuantánamoLos resultados demostraron una respuesta diferente de la interacción de HMA con los diferentes niveles de abonado orgánico. Los mejores resultados se obtuvieron con los niveles más bajos de la combinación de Suelo: Humus de lombriz: Fibra de Coco (S:H:FC), 10:1:1 y 4:1:1. En el suelo ARh (vivero de Playa Duaba), la cepa R. irregularis mostró resultados similares a los controles, mientras que en el suelo GFLh (vivero de Cabacú), las tres cepas obtuvieron similar respuesta. Mediante el empleo de los HMA se logró sustituir el 75 % del abono orgánico.
Detalles del artículo

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes de la Licencia CC Reconocimiento-NoComercial 4.0 Internacional (CC BY-NC 4.0):
Usted es libre de:
- Compartir — copiar y redistribuir el material en cualquier medio o formato
- Adaptar — remezclar, transformar y crear a partir del material
El licenciador no puede revocar estas libertades mientras cumpla con los términos de la licencia.
Bajo las condiciones siguientes:
- Reconocimiento — Debe reconocer adecuadamente la autoría, proporcionar un enlace a la licencia e indicar si se han realizado cambios. Puede hacerlo de cualquier manera razonable, pero no de una manera que sugiera que tiene el apoyo del licenciador o lo recibe por el uso que hace.
- NoComercial — No puede utilizar el material para una finalidad comercial.
- No hay restricciones adicionales — No puede aplicar términos legales o medidas tecnológicas que legalmente restrinjan realizar aquello que la licencia permite.
La revista no se responsabiliza con las opiniones y conceptos emitidos en los trabajos, son de exclusiva responsabilidad de los autores. El Editor, con la asistencia del Comité de Editorial, se reserva el derecho de sugerir o solicitar modificaciones aconsejables o necesarias. Son aceptados para publicar trabajos científico originales, resultados de investigaciones de interés que no hayan sido publicados ni enviados a otra revista para ese mismo fin.
La mención de marcas comerciales de equipos, instrumentos o materiales específicos obedece a propósitos de identificación, no existiendo ningún compromiso promocional con relación a los mismos, ni por los autores ni por el editor.
Citas
Field KJ, Pressel S. Unity in diversity: structural and functional insights into the ancient partnerships between plants and fungi. New Phytologist. 2018;220(4):996-1011.
Lara-Pérez LA, Oros-Ortega I, Córdova-Lara I, EstradaMedina H, O’Connor-Sánchez A, Góngora-Castillo E, et al. Seasonal shifts of arbuscular mycorrhizal fungi in Cocos nucifera roots in Yucatan, Mexico. Mycorrhiza. 2020;30(2):269-83.
OSDE Agroforestal. Programa de Desarrollo del Cocotero en Cuba 2017-2030. La Habana, Cuba: Ministerio de la Agricultura; 2017 p. 88.
Alvarado Ruffo K. Manejo agroecológico de la producción de posturas de cocotero (Cocos nucifera, L.) ENT#091;DoctoralENT#093;. ENT#091;Mayabeque, CubaENT#093;: Universidad Agraria de la Habana “Fructuoso Rodríguez Pérez”; 2019. 98 p.
Sarmiento-López LG, López-Meyer M, SepúlvedaJiménez G, Cárdenas L, Rodríguez-Monroy M. Photosynthetic performance and stevioside concentration are improved by the arbuscular mycorrhizal symbiosis in Stevia rebaudiana under different phosphate concentrations. PeerJ. 2020;8:e10173.5
Della Mónica IF, Godeas AM, Scervino JM. In vivo modulation of arbuscular mycorrhizal symbiosis and soil quality by fungal P solubilizers. Microbial ecology. 2020;79(1):21-9.
Salvioli di Fossalunga A, Novero M. To trade in the field: the molecular determinants of arbuscular mycorrhiza nutrient exchange. Chemical and Biological technologies in Agriculture. 2019;6(1):1-12.
Le Pioufle O, Ganoudi M, Calonne-Salmon M, Ben Dhaou F, Declerck S. Rhizophagus irregularis MUCL 41833 improves phosphorus uptake and water use efficiency in maize plants during recovery from drought stress. Frontiers in plant science. 2019;10:897.
Wang F. Arbuscular mycorrhizas and ecosystem restoration. In: Arbuscular mycorrhizas and stress tolerance of plants [Internet]. Singapur: Springer; 2017. p. 245-92. Available from: https://link.springer.com/book/ 10.1007/978-981-10-4115-0
Quiroga G, Erice G, Aroca R, Zamarreño ÁM, García-MinaJM, Ruiz-Lozano JM. Arbuscular mycorrhizal symbiosis and salicylic acid regulate aquaporins and root hydraulic properties in maize plants subjected to drought. Agricultural water management. 2018;202:271-84.
Alaux P-L. Does the arbuscular mycorrhizal fungus Rhizophagus irregularis mitigate late blight in potato plants? [Internet]. Louvain, B;elgica: Presses universitaires de Louvain; 2020. Available from: https://books.google. com.cu/books?hl=es&lr=&id=lkkMEAAAQBAJ&oi=fnd&pg =PA9&dq=Alaux+PL.++Does+the+arbuscular+mycorrhiza l+fungus+Rhizophagus+irregularis+mitigate+late+blight+in +potato+plants%3F+%5BTesis+doctoral%5D.+%5BLouv ain,+B%C3%A9lgica%5D:+Universit%C3%A9+catholique +de+Louvain,+Facult%C3%A9+des+bioing%C3%A9nieur s%3B+2020.+316+p.&ots=hms_KA3ztf&sig=scCqR_YH1 MD2HkMTcCQEMCfFlJE&redir_esc=y#v=onepage&q&f=f alse.
Marquez N, Giachero ML, Gallou A, Debat HJ, Declerck S,Ducasse DA. Transcriptome analysis of mycorrhizal and nonmycorrhizal soybean plantlets upon infection with Fusarium virguliforme, one causal agent of sudden death syndrome. Plant Pathology. 2019;68(3):470-80.
Noval-Pons BM de la, León-Díaz O, Martínez-GallardoNA, Pérez-Ortega E, Délano-Frier JP. Patrón de la actividad de las β -1,3-glucanasas y quitinasas en la interacción HMA-sistemina en tomate. I. Fase presimbiótica. Cultivos Tropicales. 2018;38(4):84-91. doi:10.1234/ct.v38i4.1409
Noval-Pons BM, León-Díaz O, Martínez-Gallardo NA, Pérez-Ortega E, Délano-Frier JP. Patrón de la actividad de las β-1, 3-glucanasas y quitinasas en la interacción HMAsistemina en tomate. II Fase temprana de la simbiosis. Cultivos Tropicales. 2017;38(3):36-43.
Hernández JA, Pérez JJM, Bosch ID, Castro SN.Clasificación de los suelos de Cuba 2015. Mayabeque, Cuba: Ediciones INCA. 2015.
Alvarado-Ruffo K, Blanco-Imbert A, Martín-Alonso GM,Ríos-Rocafull Y, Capdesuñer-Rojas R, Matos-Thompson K, et al. Influencia de un sistema de abonado orgánico y Azotobacter chroococcum sobre posturas de cocotero. Cultivos Tropicales [Internet]. 2019;40(1). Available from: https://ediciones.inca.edu.cu/index.php/ediciones/article/v iew/1495
Paneque VM, Calaña JM, Calderón M, Borges Y,Hernández T, Caruncho M. Manual de técnicas analíticas para análisis de suelo, foliar, abonos orgánicos y fertilizantes químicas. San José de las Lajas, Cuba: Instituto Nacional de Ciencias Agrícolas [Internet]. Mayabeque, Cuba; 2010. Available from: https://edi ciones.inca.edu.cu/files/folletos/folleto_suelos.pdf
Herrera-Peraza RA, Furrazola E, Ferrer RL, Valle RF,Arias YT. Functional strategies of root hairs and arbuscular mycorrhizae in an evergreen tropical forest, Sierra del Rosario, Cuba. Revista CENIC Ciencias Biológicas. 2004;35(2):113-24.
Alonso M, Cueto JR, Santos Y, Romero W, LLauger R,Rohde W. Variabilidad morfológica y molecular de una población de cocoteros verdes en la región de Baracoa. Cultivos Tropicales. 2007;28(3):69-75.
Rodríguez Y, Dalpé Y, Séguin S, Fernández K, FernándezF, Rivera RA. Glomus cubense sp. nov., an arbuscular mycorrhizal fungus from Cuba. Mycotaxon. 2011;118(1):5.
Schüβler A, Walker C. Evolution of the’PlantSymbiotic’Fungal Phylum, Glomeromycota. En: Evolution of fungi and fungal-like organisms [Internet]. Berlin, Alemania: Springer-Verlag Berlin Heidelberg; 2011. p. 164-85. Available from: https://research-repository.uwa. edu.au/en/publications/evolution-of-the-plant-symbiotic-fu ngal-phylum-glomeromycota
Giovannetti M, Mosse B. An evaluation of techniques formeasuring vesicular arbuscular mycorrhizal infection in roots. New phytologist. 1980;84:489-500.
Espinosa J, Ortea J, Moro L. Nueva especie de margineladel género Prunum Herrmannsen, 1852 (Mollusca: Neogastropoda: Marginellidae), del Parque Nacional Alejandro de Humboldt, sector Baracoa, Cuba. Academia Canaria de Ciencia. 2008;20(4):19-22.
Lovera M, Cuenca G. Diversidad de hongos micorrízicosarbusculares (HMA) y potencial micorrízico del suelo de una sabana natural y una sabana perturbada de la gran sabana, Venezuela. Interciencia. 2007;32(2):108-14.
Furrazola E, Covacevich F, Torres-Arias Y, RodríguezRodríguez RM, Ley-Rivas JF, Izquierdo K, et al. Functionality of arbuscular mycorrhizal fungi in three plant communities in the Managed Floristic Reserve San Ubaldo-Sabanalamar, Cuba. Revista de Biología Tropical.
;63(2):341-56.
Gómez EFF, Rodríguez RMR, Arias YT, González SG,Fors RO, Rivas JFL. Hongos micorrizógenos arbusculares (Glomeromycotina) en ecosistemas naturales y agrícolas en la Reserva de la Biosfera Ciénaga de Zapata, Cuba. Acta Botánica Cubana [Internet]. 2018;217(1). Available from: http://www.revistasgeotech.com/index.php/abc/artic le/view/225
Choi J, Summers W, Paszkowski U. Mechanismsunderlying establishment of arbuscular mycorrhizal symbioses. Annual Review of Phytopathology. 2018;56:135-60.
Deng Y, Feng G, Chen X, Zou C. Arbuscular mycorrhizalfungal colonization is considerable at optimal Olsen-P levels for maximized yields in an intensive wheat-maize cropping system. Field Crops Research. 2017;209:1-9.
Calabrese S, Kohler A, Niehl A, Veneault-Fourrey C,Boller T, Courty P-E. Transcriptome analysis of the Populus trichocarpa-Rhizophagus irregularis mycorrhizal symbiosis: regulation of plant and fungal transportomes under nitrogen starvation. Plant and Cell Physiology.
;58(6):1003-17.
de Oliveira PTF, Dos Santos EL, da Silva WAV, FerreiraMRA, Soares LAL, da Silva FA, et al. Use of mycorrhizal fungi releases the application of organic fertilizers to increase the production of leaf vitexin in yellow passion fruit. Journal of the Science of Food and Agriculture.
;100(4):1816-21.
Saia S, Aissa E, Luziatelli F, Ruzzi M, Colla G, Ficca AG,et al. Growth-promoting bacteria and arbuscular mycorrhizal fungi differentially benefit tomato and corn depending upon the supplied form of phosphorus. Mycorrhiza. 2020;30(1):133-47.
Verzeaux J, Hirel B, Dubois F, Lea PJ, Tétu T. Agriculturalpractices to improve nitrogen use efficiency through the use of arbuscular mycorrhizae: Basic and agronomic aspects. Plant Science. 2017;264:48-56.
Ilangamudali I, Senarathne SHS. Effectiveness ofArbuscular Mycorrhizal Fungi based biofertilizer on early growth of coconut seedlings. 2016;(22):1-12.