Microorganismos benéficos antagónicos de Curvularia petersonii causante de lesiones foliares en caña de azúcar
Contenido principal del artículo
Resumen
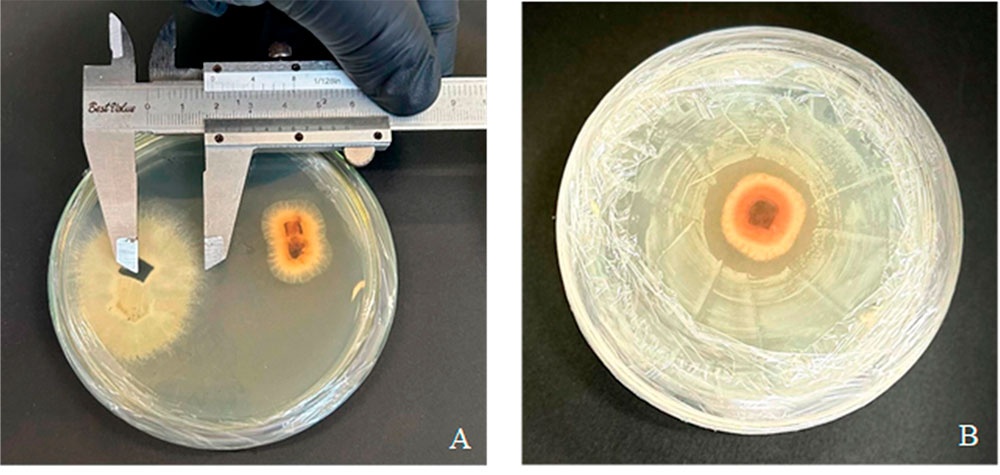
La necrosis foliar en caña de azúcar provocada por hongos fitopatógenos es un problema grave, como alternativa de biocontrol existen los microorganismos benéficos que podrían ofrecer una solución sostenible. Este estudio evalúa el potencial de microorganismos benéficos como biocontroladores efectivos. El objetivo del estudio consistió en evaluar el efecto antagónico de microorganismos benéficos frente a Curvularia petersonii hongo fitopatógeno responsable de necrosis foliares en cultivo de caña azucarera. Se replicó una cepa secuenciada con el 99,60 % de identidad para C. petersonii (Nº Accesión NR_158448.1) para evaluar el porcentaje de inhibicion (Trichoderma harzianum, Trichoderma asperellum, Bacillus subtilis y Pseudomona fluorescens) con 5 réplicas y sus respectivos controles durante 16 días de evaluación utilizado la técnica del modelamiento matemático del crecimiento exponencial, con la finalidad de modelar el desarrollo de C. petersonii en condiciones in vitro y en presencia de microorganismos antagonistas bajo la ecuación diferencial logística del modelo Lotka-Volterra para enfrentamiento por cultivo dual. Los resultados sostienen que los microorganismos benéficos utilizados tuvieron un efecto antagónico inhibitorio sobre el hongo fitopatógeno C. petersonii, concluyendo que estos microorganismos poseen bondades como biocontroladores frente a C. petersonii.
Detalles del artículo

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes de la Licencia CC Reconocimiento-NoComercial 4.0 Internacional (CC BY-NC 4.0):
Usted es libre de:
- Compartir — copiar y redistribuir el material en cualquier medio o formato
- Adaptar — remezclar, transformar y crear a partir del material
El licenciador no puede revocar estas libertades mientras cumpla con los términos de la licencia.
Bajo las condiciones siguientes:
- Reconocimiento — Debe reconocer adecuadamente la autoría, proporcionar un enlace a la licencia e indicar si se han realizado cambios. Puede hacerlo de cualquier manera razonable, pero no de una manera que sugiera que tiene el apoyo del licenciador o lo recibe por el uso que hace.
- NoComercial — No puede utilizar el material para una finalidad comercial.
- No hay restricciones adicionales — No puede aplicar términos legales o medidas tecnológicas que legalmente restrinjan realizar aquello que la licencia permite.
La revista no se responsabiliza con las opiniones y conceptos emitidos en los trabajos, son de exclusiva responsabilidad de los autores. El Editor, con la asistencia del Comité de Editorial, se reserva el derecho de sugerir o solicitar modificaciones aconsejables o necesarias. Son aceptados para publicar trabajos científico originales, resultados de investigaciones de interés que no hayan sido publicados ni enviados a otra revista para ese mismo fin.
La mención de marcas comerciales de equipos, instrumentos o materiales específicos obedece a propósitos de identificación, no existiendo ningún compromiso promocional con relación a los mismos, ni por los autores ni por el editor.
Citas
Vera J, Lazo R, Barzallo D, Gavin C. Caracterización química y degradabilidad in situ de residuos orgánicos como alternativa alimenticia para bovinos. Ecuadorian Sci J. 2021;5(4):1-14. Available from: https://doi.org/10.21930/rcta.vol25_num1_art:3306274
Kong C-Y, Wickramasinghe KP, Xu C-H, Mao J, Liu H-B, Kumar T, et al. Recent advances in sugarcane leaf scald disease: Pathogenic insights and sustainable management approaches. Plants [Internet]. 2025;14(4):508. Available from: https://doi.org/10.3390/plants14040508
Jernisha J, Poorniammal R, Sivakumar U, Harish S, Sethuraman K. Plant growth promoting microorganisms and emerging biotechnological approaches for sugarcane disease management. J Pure Appl Microbiol [Internet]. 2024;18(4). Available from: https://doi.org/10.22207/JPAM.18.4.27
Ahmad S, Wang M, Zhang H, Deng Y, Liang Q, He B, et al. Synergistic application of biochar and lime modulates rhizosphere microbiome, suppresses pathogens, and enhances disease resistance in sugarcane. BMC Microbiology [Internet]. 2025;25(1):622. Available from: https://doi.org/10.1186/s12866-025-04355-z
Guo Z-J, Amenyogbe MK, Chen S-Q, Rashad YM, Deng J-X, Luo H. Morphological and phylogenetic analyses reveal two novel species of Curvularia (Pleosporales, Pleosporaceae) from southern China. MycoKeys [Internet]. 2025;120:139. Available from: https://doi.org/10.3897/mycokeys.120.156570
Srivastava AK, Khan M, Li X, Misra P, Ashish, Kumar A, et al. Exploring the impact of Curvularia pathogens on medicinal and aromatic plants: insights into history, pathogenicity, and host-pathogen interactions. World J Microbiol Biotechnol [Internet]. 2025;41(7):252. Available from: https://doi.org/10.1007/s11274-025-04421-8
Singh V, Lakshman DK, Roberts DP, Ismaiel A, Abhishek A, Kumar S, et al. Fungal species causing maize leaf blight in different agro-ecologies in India. Pathogens [Internet]. 2021;10(12):1621. Available from: https://doi.org/10.3390/pathogens10121621
Yusifova A, Asadova B, Aslanova S. Evaluation of phytopathogenic fungi according to the degree of danger. Adv Stud Biol [Internet]. 2025;17(1):27-36. Available from: https://doi.org/10.12988/asb.2025.91987
Tongsri V, Apithanasakulngeon P, Songkumarn P, Suttiviriya P, Chanchula N. Fungicide resistance of chrysanthemum fungal pathogens and control of leaf spot disease in pot conditions using effective fungicides. Int J Agric Technol [Internet]. 2025;21(4):1577-96. Available from: https://doi.org/10.63369/ijat.2025.21.4.1577-1596
Rodríguez JHV, Sarango Y, Aveiga M del RV, Mata JDO, Sevilla-Carrasco JD, Cuesta JMD, et al. Effect of herbicides on the growth of beneficial microorganisms in rhizospheric soil. Rev La Fac Agron La Univ Del Zulia [Internet]. 2025;42(2). Available from: https://doi.org/10.47280/RevFacAgron(LUZ).v42.n2.VI
Karamchandani BM, Chakraborty S, Dalvi SG, Satpute SK. Chitosan and its derivatives: Promising biomaterial in averting fungal diseases of sugarcane and other crops. J Basic Microbiol [Internet]. 2022;62(5):533-54. Available from: https://doi.org/10.1002/jobm.202100613
Rodríguez JHV, Mercedes MMM, Fernanda AFA, Enrique BEB, Liliana RLR. Microorganismos benéficos, bioestimuladores de la germinación y emergencia de semillas de maíz (Zea mays L.). Multidiscip Collab J [Internet]. 2025;3(3):58-69. Available from: https://doi.org/10.70881/mcj/v3/n3/70
Carpio M, Vera J, Yugsan F, Gavin C, Barzallo D. Biofertilizer enriched with Paenibacillus polymyxa and Trichoderma sp. for radish cultivation. Revista Caatinga [Internet]. 2025;38:e13759-e13759. Available from: https://doi.org/10.1590/1983-21252025v3813759rc
Vera Rodríguez JH, Barzallo D, Villamar Aveiga M del R, Barcia-Anchundia JX. Biostimulant effect of microorganisms on in vitro germination of hybrid pepper seeds. Rev Cienc y Tecnol Agropecu. 2024;25(1).
Ren Q, Khan A, Zhang J, Bao Y, Khan MT, Wang J, et al. Fungal community dynamics associated with the outbreaks of sugarcane root rot disease. Microbiol Spectr [Internet]. 2024;12(2):e03090-23. Available from: https://doi.org/10.1128/spectrum.03090-23
Jeres-Caguana GA, Montaño-Roldan VL, Ordoñez-Zuñiga NL, Vera-Rodriguez JH, Lucas-Vidal LR. Efecto biorremediador de la espirulina y Trichoderma spp. en suelo contaminado con plomo (Pb). Multidiscip Collab Journal [Internet]. 2025;3(2):1-12. Available from: https://doi.org/10.70881/mcj/v3/n2/48
Cortés-Hernández F del C, Alvarado-Castillo G, Sánchez-Viveros G. Trichoderma spp., una alternativa para la agricultura sostenible: una revisión. Revista Colomb Biotecnol [Internet]. 2023;25(2):73-87. Available from: https://doi.org/10.15446/rev.colomb.biote.v25n2.111384
Peralta JT, Guerra EG, Pruna DC, Erazo VS. Evaluación in vitro del antagonismo de cepas de Trichoderma contra hongos fitopatógenos foliares del cultivo de banano (Musa spp.). Agroindustrial Sci [Internet]. 2025;15(2):143-53. Available from: http://doi.org/10.17268/agroind.sci.2025.02.06
Martínez-Canto OJ, Cristóbal-Alejo J, Tun-Suárez JM, Reyes-Ramírez A. Detección de genes Epl1 y Sm1 en Trichoderma spp. antagonistas contra hongos fitopatógenos. Ecosistemas y Recursos Agropecurios [Internet]. 2021;8(2). Available from: https://doi.org/10.19136/era.a8n2.2791
Álvarez-García J-A, Santoyo G, del Carmen Rocha-Granados M. Pseudomonas fluorescens: Mecanismos y aplicaciones en la agricultura sustentable. Revista Latinoamericana Recursos Naturales [Internet]. 2020;16(1):1-10. Available from: https://revista.itson.edu.mx/index.php/rlrn/article/view/286
de los M Orberá T, de Jesús Serrat M, Ortega E. Potential applications of Bacillus subtilis strain SR/B-16 for the control of phytopathogenic fungi in economically relevant crops. Biotecnol Apl [Internet]. 2014;31(1):7-12. Available from: https://www.medigraphic.com/cgi-bin/new/resumenI.cgi?IDARTICULO=48662