In vitro antagonistic effect of Trichoderma asperellum against Moniliophthora perniciosa
Main Article Content
Abstract
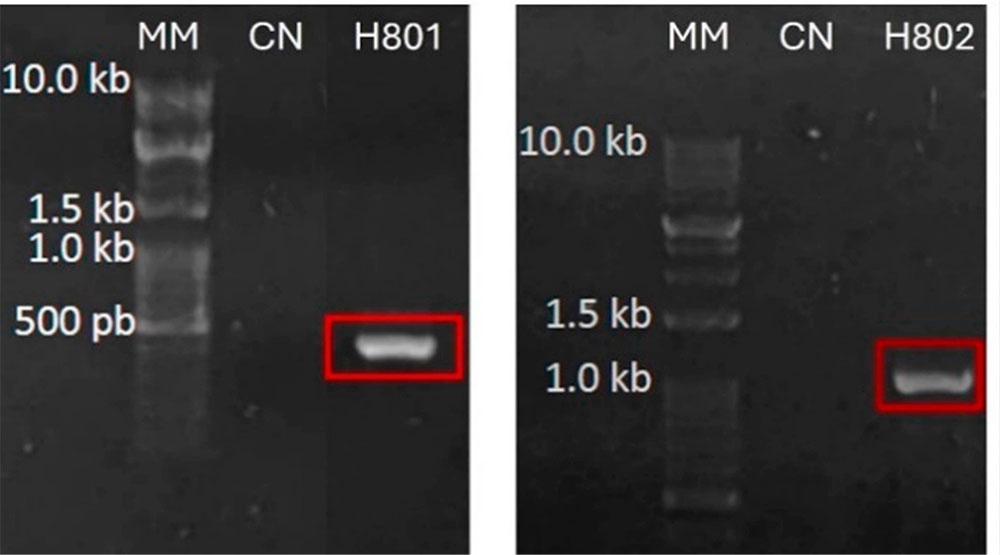
The study of phytopathogenic fungi in cacao plantations is essential for crop protection and the development of effective control strategies. The objective of this study was to evaluate the in vitro antagonistic effect of Trichoderma asperellum against Moniliophthora perniciosa, which causes the disease "witches' broom." Both species (M. perniciosa from diseased cacao (Theobroma cacao L.) branches and T. asperellum from the rhizosphere) were isolated and molecularly identified using ITS barcoding and beta tubulin techniques. Exponential growth mathematical modeling was applied to model the growth of M. perniciosa in the presence of the antagonistic fungus T. asperellum. Logistic differential calculation based on the Lotka-Volterra model for competition was applied. The trial included 5 replicates with their respective controls. Molecular analysis confirmed the presence of M. perniciosa at 98 % and T. asperellum at 100 %. In vitro assays demonstrated that T. asperellum effectively inhibits M. perniciosa through competition. The Lotka-Volterra model predicted T. asperellum dominance. In conclusion, the molecular, in vitro, and modeling results provide a solid basis for considering T. asperellum as a promising biocontrol agent for cacao witches' broom disease under controlled conditions.
Article Details

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
Those authors who have publications with this journal accept the following terms of the License Attribution-NonCommercial 4.0 International (CC BY-NC 4.0):
You are free to:
- Share — copy and redistribute the material in any medium or format
- Adapt — remix, transform, and build upon the material
The licensor cannot revoke these freedoms as long as you follow the license terms.
Under the following terms:
- Attribution — You must give appropriate credit, provide a link to the license, and indicate if changes were made. You may do so in any reasonable manner, but not in any way that suggests the licensor endorses you or your use.
- NonCommercial — You may not use the material for commercial purposes.
- No additional restrictions — You may not apply legal terms or technological measures that legally restrict others from doing anything the license permits.
The journal is not responsible for the opinions and concepts expressed in the works, they are the sole responsibility of the authors. The Editor, with the assistance of the Editorial Committee, reserves the right to suggest or request advisable or necessary modifications. They are accepted to publish original scientific papers, research results of interest that have not been published or sent to another journal for the same purpose.
The mention of trademarks of equipment, instruments or specific materials is for identification purposes, and there is no promotional commitment in relation to them, neither by the authors nor by the publisher.
References
Vera-Rodríguez JH, Duarte-Cuesta JM, del Rocío Villamar-Aveiga M, Sevilla-Carrasco JD, Ortiz-Mata JD, Gavin-Moyano CS, et al. Morphological characterization, molecular identification, and phylogenetic analysis of Lasiodiplodia theobromae associated with CCN-51 cacao plants in Ecuador. Sci Agropecu [Internet]. 2025 Aug 8 [cited 2025 Sep 8];16(4):513-9. Available from: https://doi.org/10.17268/sci.agropecu.2025.039
Peralta SLP, Herrera CW, Castro B del RG. Estimación de pérdidas económicas en Cacao causado por Escoba de Bruja (Crinipellis Perniciosa) y Monilia (Monilia Roreri) en pequeños productores. Rev la Univ del Zulia [Internet]. 2024;15(42):179-92. Available from: https://doi.org/10.46925//rdluz.42.10
Sánchez MAL, Aguayo AAA, Campoverde AG. El Análisis comparativo sobre la incidencia de las tres principales enfermedades en el cacao CCN-51, en el cantón La Troncal, provincia del Cañar, Ecuador. Rev Científica Ciencias Nat y Ambient [Internet]. 2018;12(1). Available from: https://doi.org/10.53591/cna.v12i1.271
Villa-Martínez A, Pérez-Leal R, Morales-Morales HA, Basurto-Sotelo M, Soto-Parra JM, Martínez-Escudero E. Situación actual en el control de Fusarium spp. y evaluación de la actividad antifúngica de extractos vegetales. Acta agronómica [Internet]. 2015;64(2):194-205. Available from: https://doi.org/10.15446/acag.v64n2.43358
Bobadilla CCC, Ruíz JRC. Efecto antifúngico del aceite esencial de Origanum vulgare sobre el crecimiento micelial de Rhizoctonia solani. Sagasteguiana [Internet]. 2015;3(1):79-86. Available from: https://revistas.unitru.edu.pe/index.php/REVSAGAS/article/view/2011
Jeres-Caguana GA, Montaño-Roldan VL, Ordoñez-Zuñiga NL, Vera-Rodriguez JH, Lucas-Vidal LR. Efecto biorremediador de la espirulina y Trichoderma spp. en suelo contaminado con plomo (Pb). Multidiscip Collab J [Internet]. 2025;3(2):1-12. Available from: https://doi.org/10.70881/mcj/v3/n2/48
Vera J, Sarango Y, Villamar M, Ortiz J, Sevilla-Carrasco J, Duarte J LL. Effect of herbicides on the growth of beneficial microorganisms in rhizospheric soil. Rev Fac Agron [Internet]. 2025;42(2):e254222. Available from: https://www.produccioncientificaluz.org/index.php/agronomia/article/view/43831
Parraguirre-Lezama C, Romero-Arenas O, Cruz Coronel A, Mauricio-Gutiérrez A, Contreras-Paredes CA, Rivera Tapia A. Toxicidad de fungicidas de contacto en cuatro especies de Trichoderma, un enfoque de compatibilidad in vitro. Rev Mex Fitopatol [Internet]. 2025;43(1). Available from: https://doi.org/10.18781/r.mex.fit.2402-7
Rios-Catota DV, Álvarez-Sánchez AR, Vera-Rodríguez JH. Biosíntesis de nanopartículas de plata mediante Trichoderma asperellum y su impacto en el crecimiento vegetativo del maíz (Zea mays L.). Multidiscip Collab J [Internet]. 2025;3(2):148-58. Available from: https://doi.org/10.70881/mcj/v3/n2/57
Cruz A, Rivero D, Echevarría A, Rodríguez AT. Manejo de hongos fitopatógenos en Oryza sativa con la aplicación de Trichoderma asperellum. Cultiv Trop [Internet]. 2022;43(4):1-5. Available from: https://cu-id.com/2050/v43n4e01
Duarte-Leal Y, Lamz-Piedra A, Martínez-Coca B. Antagonismo in vitro de aislamientos de Trichoderma asperellum Samuels, Lieckfeldt & Nirenberg frente a Sclerotium rolfsii Sacc. Rev protección Veg [Internet]. 2017;32(3):0. Available from: http://scielo.sld.cu/scielo.php?pid=S1010-27522017000300003&script=sci_arttext
Martínez B, Infante D, Reyes Y. Trichoderma spp. y su función en el control de plagas en los cultivos. Rev Protección Veg [Internet]. 2013;28(1):1-11. Available from: http://scielo.sld.cu/scielo.php?pid=s1010-27522013000100001&script=sci_arttext
Mesa-Vanegas AM, Marin A, Calle-Osorno J. Metabolitos secundarios en Trichoderma spp. y sus aplicaciones biotecnológicas agrícolas. Actual biológicas [Internet]. 2019;41(111):32-44. Available from: https://doi.org/10.17533/udea.acbi.v41n111a02
Camacho-Luna V, Flores-Moctezuma HE, Rodríguez-Monroy M, Montes-Belmont R, Sepúlveda-Jiménez G. Inducción de la respuesta de defensa de plantas de cebolla en la interacción con Trichoderma asperellum y Alternaria porri. Rev Mex ciencias agrícolas [Internet]. 2021;12(4):685-98. Available from: https://doi.org/10.29312/remexca.v12i4.2683
Tirado-Gallego PA, Lopera-Álvarez A, Ríos-Osorio LA. Estrategias de control de Moniliophthora roreri y Moniliophthora perniciosa en Theobroma cacao L.: revisión sistemática. Cienc y Tecnol Agropecu [Internet]. 2016;17(3):417-30. Available from: http://dx.doi.org/10.21930/rcta.vol17_num3_art:517
Lopes MA, Gomes DS, Koblitz MGB, Pirovani CP, de Mattos Cascardo JC, Góes-Neto A, et al. Use of response surface methodology to examine chitinase regulation in the basidiomycete Moniliophthora perniciosa. Mycol Res [Internet]. 2008;112(3):399-406. Available from: https://doi.org/10.1016/j.mycres.2007.10.017
Garcia O, Macedo JAN, Tibúrcio R, Zaparoli G, Rincones J, Bittencourt LMC, et al. Characterization of necrosis and ethylene-inducing proteins (NEP) in the basidiomycete Moniliophthora perniciosa, the causal agent of witches’ broom in Theobroma cacao. Mycol Res [Internet]. 2007;111(4):443-55. Available from: https://doi.org/10.1016/j.mycres.2007.01.017
Rivera-Fernández RD, Valarezo-Beltron O, Macías LV, Chavarría-Párraga JE, Cedeño ÁMG. Efecto de la poda fitosanitaria sobre la enfermedad escoba de bruja en el cultivo de cacao. Intropica Rev del Inst Investig Trop [Internet]. 2014;9(1):129-36. Available from: https://dialnet.unirioja.es/servlet/articulo?codigo=5111585
Almestar-Montenegro J, Leiva-Espinoza S, Borjas-Ventura R, Valderrama-Palacios D, León-Rojas F, Castro-Cepero V, et al. Efecto de la poda y la remoción de frutos sobre las enfermedades de la mazorca de cacao en Copallín, Amazonas, Perú. Idesia (Arica) [Internet]. 2024;42(4):69-77. Available from: http://dx.doi.org/10.4067/s0718-34292024000400069
Hernández-Villegas J. Incidencia de la escoba de bruja (Crinipellis perniciosa) sobre el rendimiento de dos agroecosistemas de cacao con diferentes condiciones de manejo. Bioagro [Internet]. 2016;28(1):59-64. Available from: https://ve.scielo.org/scielo.php?pid=S1316-33612016000100008&script=sci_arttext
White TJ, Bruns T, Lee S, Taylor J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protoc a Guid to methods Appl [Internet]. 1990;18(1):315-22. Available from: https://doi.org/10.1016/B978-0-12-372180-8.50042-1
Glass NL, Donaldson GC. Development of primer sets designed for use with the PCR to amplify conserved genes from filamentous ascomycetes. Appl Environ Microbiol [Internet]. 1995;61(4):1323-30. Available from: https://doi.org/10.1128/aem.61.4.1323-1330.1995
Guigón-López C, Guerrero-Prieto V, Vargas-Albores F, Carvajal-Millán E, Ávila-Quezada GD, Bravo-Luna L, et al. Identificación molecular de cepas nativas de Trichoderma spp. su tasa de crecimiento in vitro y antagonismo contra hongos fitopatógenos. Rev Mex Fitopatol [Internet]. 2010;28(2):87-96. Available from: https://www.scielo.org.mx/scielo.php?pid=S0185-33092010000200002&script=sci_arttext
Mondego JMC, Carazzolle MF, Costa GGL, Formighieri EF, Parizzi LP, Rincones J, et al. A genome survey of Moniliophthora perniciosa gives new insights into Witches’ Broom Disease of cacao. BMC Genomics [Internet]. 2008;9:1-25. Available from: https://doi.org/10.1186/1471-2164-9-548
Cano MA. Interacción de microorganismos benéficos en plantas: Micorrizas, Trichoderma spp. y Pseudomonas spp. Una revisión. Rev UDCA Actual Divulg Científica [Internet]. 2011;14(2):15-31. Available from: http://www.scielo.org.co/scielo.php?pid=S0123-42262011000200003&script=sci_arttext